Trắc nghiệm chương 7: Tốc độ phản ứng và cân bằng hóa học phần 1
Chuyên đề Hóa học lớp 10: Trắc nghiệm chương 7: Tốc độ phản ứng và cân bằng hóa học phần 1 được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Bài tập trắc nghiệm chương 7
Câu 1: Phát biểu nào sau đây đúng?
A. Khi đốt củi, nếu thêm một ít dầu hỏa, lửa sẽ cháy mạnh hơn. Như vậy dầu hỏa là chất xúc tác cho quá trình này.
B. Trong quá trình sản xuất rượu (ancol) từ gạo người ta rắc men lên gạo đã nấu chín (cơm) trước khi đem ủ vì men là chất xúc tác có tác dụng làm tăng tốc độ phản ứng chuyển hóa tinh bột thành rượu.
C. Một chất xúc tác có thể xúc tác cho tất cả các phản ứng.
D. Có thể dùng chất xúc tác để làm giảm tốc độ của phản ứng.
Đáp án B
Câu 2: Khi đốt củi, để tăng tốc độ cháy, người ta sử dụng biện pháp nào sau đây?
A. Đốt trong lò kín.
B. Xếp củi chặt khít.
C. Thổi hơi nước.
D. Thổi không khí khô.
Đáp án D
Câu 3: Tốc độ phản ứng của chất khí sẽ giảm khi:
A. Tăng nồng độ chất tham gia
B. Giảm áp suất của chất khí
C. Tăng nhiệt độ
D. Thêm chất xúc tác.
Đáp án B
Câu 4: Tốc độ phản ứng cho biết:
A. Độ biến thiên nồng độ các chất phản ứng hoặc sản phẩm trong một đơn vị thời gian
B. Mức độ xảy ra nhanh hay chậm của phản ứng hóa học
C. Ảnh hưởng của nhiệt độ, áp suất đến phản ứng hóa học
D. Tổng số độ biến thiên nhanh hay chậm của phản ứng hóa học.
Đáp án A
Câu 5: Đối với phản ứng phân hủy H2O2 trong nước, khi thay đổi yếu tố nào sau đây, tốc độ phản ứng không thay đổi?
A. Thêm MnO2
B. Tăng nồng độ H2O2
C. Đun nóng
D. Tăng áp suất H2
Đáp án D
Câu 6: Người ta sử dụng các biện pháp sau để tăng tốc độ phản ứng:
Dùng khí nén, nóng thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang).
Nung đá vôi ở nhiệt độ cao để sản xuất vôi sống.
Nghiền nguyên liệu trước khi nung để sản xuất clanhke.
Cho bột sắt làm xúc tác trong quá trình sản xuất NH3 từ N2 và H2.
Trong các biện pháp trên, có bao nhiêu biện pháp đúng?
A. 1 B. 2 C. 3 D. 4
Đáp án D
Câu 7: Cho cân bằng hóa học sau:
2SO2 (k) + O2 (k) ⇋ 2SO3 (k) ; ΔH< 0
Cho các biện pháp:
Tăng nhiệt độ;
Tăng áp suất chung của hệ phản ứng;
Hạ nhiệt độ;
Dùng thêm chất xúc tác V2O5;
Giảm nồng độ SO3;
Giảm áp suất chung của hệ phản ứng.
Trong các biện pháp trên, những biện pháp nào làm cân bằng chuyển dịch theo chiều thuận?
A. (1), (2), (4), (5)
B. (2), (3), (5)
C. (2), (3), (4), (6)
D. (1), (2), (5)
Đáp án B
Câu 8: Cho cân bằng hóa học:
H2 (k) +I2 (k) ⇋ 2HI (k); ΔH > 0
Cân bằng không bị chuyển dịch khi
A. Tăng nhiệt độ của hệ
B. Giảm nống độ HI
C. Tăng nồng độ H2
D. Giảm áp suất chung của hệ.
Khi hệ cân bằng có số mol khí ở 2 vế bằng nhau thì việc tăng, giảm áp suất không làm cho cân bằng chuyển dịch.
Đáp án D
Câu 9: Cho cân bằng hóa học:
2SO2 (k) + O2 (k) ⇋ 2SO3 (k)
Khi tăng nhiệt độ thì tỉ khối của hỗn hợp khí so với H2 giảm đi. Phát biểu nào sau đây đúng khi nói về cân bằng hóa học này?
A. Phản ứng thuận thu nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
B. Phản ứng nghịch tỏa nhiệt, cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ.
C. Phản ứng nghịch thu nhiệt, cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ.
D. Phản ứng thuận tỏa nhiệt, cân bằng chuyển dịch theo chiều nghịch khi tăng nhiệt độ.
Đáp án D
Câu 10: Cho cân bằng hóa học sau trong bình kín:
2NO2 (k) ⇋ N2O4 (k)
(màu nâu đỏ) (không màu)
Biết khi hạ nhiệt độ của bình thì màu nâu đỏ nhạt dần. Phản ứng thuận có
A. ΔH > 0, phản ứng tỏa nhiệt
B. ΔH < 0, phản ứng tỏa nhiệt
C. ΔH > 0, phản ứng thu nhiệt
D. ΔH < 0, phản ứng thu nhiệt
Đáp án B
Câu 11: Cho cân bằng hóa học:
2SO2 (k) + O2 (k) ⇋ 2SO3 (k)
Phản ứng thuận là phản ứng tỏa nhiệt. Phát biểu nào sau đây đúng?
A. Cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ
B. Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ O2
C. Cân bằng chuyển dịch theo chiều thuận khi giảm áp suất hệ phản ứng
D. Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ SO3
Đáp án B
Câu 12: Cho cân bằng hóa học:
N2 (k) + 3H2 ⇋ 2NH3 (k)
Phản ứng thuận là phản ứng tỏa nhiệt. Cân bằng hóa học không bị chuyển dịch khi
A. Thay đổi áp suất của hệ
B. Thay đổi nồng độ N2
C. Thay đổi nhiệt độ
D. Thêm chất xúc tác Fe
Đáp án D
Câu 13: Cho các cân bằng hóa học sau:
2SO2 (k) + O2 (k) ⇋ 2SO3 (k)
N2 (k) + 3H2 ⇋ 2NH3 (k)
CO2 (k) + H2 (k) ⇋ CO (k) + H2O (k)
2HI (k) ⇋ H2 (k) + I2 (k)
Khi thay đổi áp suất, các cân bằng hóa học đều không bị chuyển dịch là
A. (1) và (3)
B. (2) và (4)
C. (1) và (2)
D. (3) và (4)
Đáp án D
Câu 14: Cho chất xúc tác MnO2 vào 100 ml dung dịch H2O2, sau 60 giây thu được 3,36 ml khí O2 (đktc). Tốc độ trung bình của phản ứng (tính theo H2O2) trong 60 giây trên là
A. 2,5.10-4mol/(l.s)
B. 5,0.10-4mol/(l.s)
C. 1,0.10-3mol/(l.s)
D. 5,0.10-4mol/(l.s)
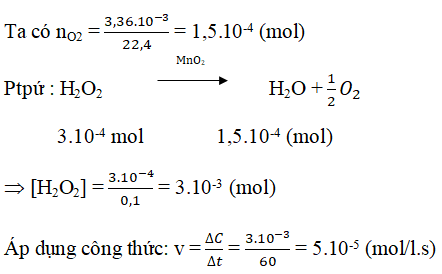
Đáp án D
Câu 15: Khi bắt đầu phản ứng, nồng độ của một chất là 0,024 mol. Sau 20 giây phản ứng, nồng độ của chất đó là 0,020 mol. Hãy tính tốc độ trung bình của phản ứng này trong thời gian đã cho.
Câu 16. Nồng độ ban đầu của A2 và B2 là 0,03 mol/l. Khi phản ứng:
A2(k) + B2(k) ⇋ 2AB(k);
Khi đạt trạng thái cân bằng, nồng độ của AB là 0,04 mol/l. Hằng số cân bằng của phản ứng trên là:
A. 9 B. 16 C. 32 D. 64
A2 (k) + B2 (k) ⇋ 2AB (k)
0,02 0,02 0,04
K = 0,042/ (0,01.0,01) = 16
Đáp án B
Câu 17. Cho cân bằng hóa học sau:
CaCO3 (r) ⇋ CaO(r) + CO2 (k); ΔH > 0
Cân bằng sẽ dịch chuyển theo chiều nghịch khi:
A. Tăng áp suất C. Liên tục đẩy CO2 ra khỏi lò
B. Tăng nhiệt độ D. Thêm chất xúc tác
Đáp án A
Câu 18. Trong một phản ứng thuận nghịch, ở trạng thái cân bằng thì:
A. Các phản ứng thuận và nghịch đều dừng lại
B. Nồng độ các chất trong hệ có giá trị cao nhất
C. Tốc độ của phản ứng thuận và nghịch gần bằng nhau
D. Nồng độ các chất trong hệ không thay đổi, được gọi là nồng độ cân bằng.
Nồng động các chất ở trạng thái cân bằng không thay đổi
Đáp án D
Câu 19. Cho phản ứng hóa học sau: 2X2 (khí) + Y2 (khí) → 2X2Y
Khi tăng nồng độ của X2 lên 2 lần đồng thời giảm nồng độ của Y2 xuống 4 lần thì tốc độ phản ứng:
A. Giảm 2 lần B. Tăng 4 lần C. Không đổi D. 8 lần
Đáp án C
Câu 20. Tốc độ phản ứng cho biết:
A. Độ biến thiên nồng độ các chất phản ứng hoặc sản phẩm trong một đơn vị thời gian
B. Mức độ xảy ra nhanh hay chậm của phản ứng hóa học
C. Ảnh hưởng của nhiệt độ, áp suất đến phản ứng hóa học
D. Tổng số độ biến thiên nhanh hay chậm của phản ứng hóa học.
Đáp án A
Trên đây VnDoc đã giới thiệu tới các bạn lý thuyết Hóa học 10: Trắc nghiệm chương 7: Tốc độ phản ứng và cân bằng hóa học phần 1. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 10, Giải bài tập Hóa học lớp 10, Giải bài tập Vật Lí 10, Tài liệu học tập lớp 10 mà VnDoc tổng hợp và giới thiệu tới các bạn đọc.








