Trắc nghiệm chương 6: Nhóm Oxi, Lưu huỳnh phần 9
Chuyên đề Hóa học lớp 10: Trắc nghiệm chương 6: Nhóm Oxi, Lưu huỳnh phần 9 được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Bài tập trắc nghiệm chương 6
Bài 1: Dẫn 3,36 lít khí H2S (đktc) vào 250 ml dung dịch KOH 2M, sau khi phản ứng hoàn toàn thu được dung dịch X. Cô cạn dung dịch X thu được m gam rắn khan. Giá trị của m là:
A. 16,5. B. 27,5. C. 14,6. D. 27,7.
Hướng dẫn giải:
Đáp án D.
nH2S = 0,15 (mol); nKOH = 2.0,25 = 0,5 (mol)
nKOH/nH2S=3,3
⇒ Tạo KS
H2S + 2KOH → K2S + H2O
0,15 0,3 0,15
m=mK2S+mKOH=0,15.110+0,2.56=27,7(g)
Bài 2: Cho 3,56 oleum H2S2O7 vào lượng dư H2O, thu được dung dịch X. Để trung hòa toàn bộ X cần V ml dung dịch NaOH 1M. Giá trị của V là
A. 80 B. 40 C. 20 D. 60
Hướng dẫn giải:
Đáp án A.
noleum = 0,02 (mol)
H2SO4.SO3 + H2O → 2H2SO4
0,02 0,04
H2SO4 + 2NaOH → Na2SO4 + 2H2O
0,04 0,08
⇒ V = 0,08 (lít)
Bài 3: Hòa tan hoàn toàn 2,44 gam hỗn hợp bột X gồm FexOy và Cu bằng dung dịch H2SO4đặc, nóng (dư). Sau phản ứng, thu được 0,504 lít khí SO2 (sản phẩm khử duy nhất, ở đktc) và dung dịch chứa 6,6 gam hỗn hợp muối sunfat. Phần trăm khối lượng của Cu trong X là
A. 39,34% B. 65,57% C. 26,23% D. 13,11%
Hướng dẫn giải:
Đáp án C
nSO2 = 0,0225 (mol)
Gọi nFe = a, nCu = b (mol), nO = c (mol)
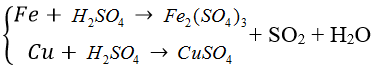
mhh = 56a+64b+16c = 2,44
mmuối = 400.0,5a+160b = 6,6
Bảo toàn electron: 3a+2b= 2c + 2.0,0225
⇒ a=0,025; b=0,01; c=0,025
![]()
Bài 4: Hòa tan hết hỗn hợp X gồm Fe, FeS, Fe3O4 trong dung dịch H2SO4 đặc, nóng (dư) thu được dung dich Y có khối lượng giảm 48 gam và 38,08 lít SO2 (đktc). Cho Y tác dụng với dung dịch NaOH (dư), lấy kết tủa rồi nung trong không khí đến khối lượng không đổi còn 64 gam chất rắn Z. Tính phần trăm theo khối lượng của Fe trong X?
A. 68% B. 73,68% C. 43,18% D.54%
Hướng dẫn giải:
Đáp án B
nSO2 = 1,7 (mol)
Chất rắn Z là Fe2O3, nFe2O3=0,4 mol
2Febđ → Fe2O3
0,8 ← 0,4 (mol)
Ta có: mX = 1,7 ×64 – 48=60,8 (gam)
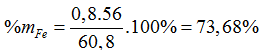
Bài 5: Hỗn hợp khí B gồm O2 và O3 có tỉ khối hơi so với H2 là 19,2. % về thể tích mỗi khí trong B là
A. 60% và 40% B. 30% và 70%
C. 20% và 80% D. 50% và 50%
Hướng dẫn giải:
Đáp án A.
Coi số mol hỗn hợp X = 1 mol.
nO2 = x,nO3 = y (mol)
x + y = 1
32x + 48y = 1.19,2.2
x = 0,6, y = 0,4 (mol)
⇒ %VO3=40%, %VO2=60%
Bài 6: Trộn 3 mol SO2 với 2 mol O2, cho hỗn hợp vào bình xin có chứa sẵn chất xúc tác, bật tia lửa điện để phản ứng xảy ra. Sau phản ứng, đưa bình về điều kiện ban đầu thì thấy áp suất trong bình giảm đi 10%, Vậy hiệu suất của phản ứng trên là:
A. 90% B. 60,67% C. 33,33% D. 50,2%
Hướng dẫn giải:
Đáp án C.
Gọi x là số mol oxi đã phản ứng, ta có:
Tổng số mol khí trước phản ứng là: 3 + 2 = 5 mol
Tổng số mol khí sau phản ứng là: 5 – x
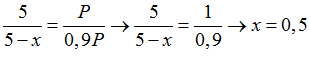
Xét tỉ lệ giữa số mol và hệ số cân bằng của SO2 và O2, SO2 hết, O2 dư
Bài 7: Đốt cháy hoàn toàn m gam FeS2 bằng một lượng O2 vừa đủ, thu được khí X. Hấp thụ hết X vào 2 lít dung dịch chứa Ba(OH)2 0,1M, thu được dung dịch Y và 21,7 gam kết tủa. Cho Y vào dung dịch NaOH, thấy xuất hiện thêm kết tủa. Giá trị của m là
A. 23, 2 B. 12, 6 C. 18,0 D. 24,0
Hướng dẫn giải:
Đáp án C
nBa(OH)2= 0,1.2 = 0,2 (mol),nBaSO3= 0,1 (mol)
nBaSO3= 2nBa(OH)2-nSO2 ⇒ nSO2=0,3 mol
FeS2 → 2SO2
0,15 ← 0,3 (mol)
nFeS2= 0,15.(56 + 32.2)=18 (g)
Bài 8: Cho 5,4 gam Al và 6,4 gam Cu tác dụng với dung dịch H2SO4 đặc, nóng, dư. Sau phản ứng thu được V lít SO2 duy nhất (đktc). Giá trị của V là
A. 6,72 lít. B. 3,36 lít. C. 11,2 lít. D. 8,96 lít.
Hướng dẫn giải:
Đáp án D.
nAl = 0,2 (mol), nCu = 0,1 (mol)
Áp dụng định luật bảo toàn electron có
2nSO2 = 3nAl + 2nCu ⇒ nSO2 = 0,4 (mol)
→ V = 0,4 . 22,4 = 8,96 lít
Bài 9: Đốt cháy hoàn toàn 80 gam pirit sắt trong không khí thu được chất rắn A và khí B. Lượng chất rắn A tác dụng vừa đủ với 200g H2SO4 29,4%. Độ nguyên chất của quặng là:
A. 60% B. 70% C. 80% D. 95%
Hướng dẫn giải:
Đáp án A.
Phương trình phản ứng
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
0,4 0,2 0,8 mol
![]()
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
0,2 0,6 mol
m = 0,4 × 120 = 48g;
![]()
Bài 10: Chỉ dùng thêm một thuốc thử nào có thể phân biệt các dung dịch sau: BaCl2, MgSO4, Na2SO3, KNO3, K2S.
A. HCl B. H2SO4 C. BaCl2 D. Ba(OH)2
Hướng dẫn giải:
Đáp án B
Trích mỗi dung dịch một ít làm mẫu thử
Cho dung dịch H2SO4 lần lượt vào các mẫu thử trên
- Mẫu thử nào tạo kết tủa trắng là BaCl2
BaCl2 + H2SO4 → BaSO4 ↓+ 2HCl
- Mẫu thử nào tạo khí mùi hắc là Na2SO3
Na2SO3 + H2SO4 → Na2SO4+ SO2 ↑+ H2O
- Mẫu thử tạo mùi trứng thối là K2S
K2S + H2SO4 → K2SO4 + H2S↑
Cho dung dịch BaCl2 vừa mới nhận được lần lượt vào hai mẫu thử còn lại:
- Mẫu thử nào tạo kết tủa trắng là MgSO4
BaCl2 + MgSO4 → BaSO4↓ + MgCl2
- Mẫu thử không có hiện tượng gì là KNO3
Bài 11: Sử dụng nước và hóa chất nào sau đây làm thuốc thử, có thể phân biệt các chất bột sau: NaCl, CaCO3, Na2S, K2SO3 , Na2SO4
A. HCl B. Qùy tím C. NaOH D. BaCl2
Hướng dẫn giải:
Đáp án A
Cho H2O lần lượt vào các mẫu thử trên
- Mẫu thử không tan trong nước là CaCO3
- Các mẫu thử còn lại ta: NaCl, Na2S, K2SO3, Na2SO4
Cho dung dịch HCl dư lần lượt vào các mẫu thử tan.
- Mẫu thử tạo khí mùi trứng thối là Na2S
Na2S +2 HCl → 2NaCl + H2S↑
- Mẫu thử tạo khí mùi hắc là K2SO3
K2SO3 +2 HCl → 2KCl+ SO2↑+ H2O
- Hai chất không có hiện tượng gì là : NaCl và Na2SO4 (nhóm 1)
Cho dung dịch HCl dư vào chất không tan trong nước, sau đó lây dung dịch vừa thu được lần lượt tác dụng với 2 chất nhóm 1.
- Mẫu thử tạo kết tảu trắng là Na2SO4
CaCl2 + Na2SO4 → CaSO4 + 2NaCl
- Mẫu thử không có hiện tượng gì là NaCl
Bài 12: Trộn 0,8 mol SO2 với 20,16 lít O2 (đktc) trong bình kín có thể tích không đổi là 100 lít, đun nóng bình đến 400oC, ở nhiệt độ này thấy áp suất trong bình là 0,8 atm. % các chất khí trong bình là:
A. SO2 10%; O2 30%; SO3 60%
B. SO2 15%; O2 70%; SO3 15%
C. SO2 10%; O2 5%; SO3 65%
D. SO2 20,69%; O2 44,83%; SO3 34,48%
Hướng dẫn giải:
Đáp án D
nO2 =0,9 (mol),nSO2 = 0,8 (mol)
2SO2 + O2 → 2SO3
Ban đầu 0,8 0,9 (mol)
Phản ứng 2x x 2x
Sau phản ứng 0,8-2x 0,9-x 2x
n sau phản ứng = 1,7-x
= 1,7 – x ⇒ x = 0,25 (mol)
Bài 13: Khi đốt 1 gam hỗn hợp đồng sunfua và kẽm sunfua có chứa 3,2% tạp chất không cháy, thu được một lượng khí có thể làm mất màu 100ml dung dịch iot 0,1M. Thành phần phần trăm theo khối lượng của hai muối sunfua trong hỗn hợp là?
A. 19,83% và 80,17%
B. 72,81% và 27,19%
C. 32,18% và 67,82%
D. 17,38% và 82,62%
Hướng dẫn giải:
Đáp án A.
2CuS + 3O2 → 2CuO + 2SO2 ↑ (1)
(mol) a → a
2ZnS + 3O2 → 2ZnO + 2SO2 ↑ (2)
(mol) b → b
SO2 + I2 + 2H2 O → H2SO4 + 2HI (3)
(mol) 0,01 0,01
Khối lượng của hỗn hợp: ZnS và CuS là:
nI2 =0,1 ×0,1=0,01(mol)
Gọi a là số mol của CuS và b là số mol của ZnS
Ta có: 96a + 97b = 0,968
a + b = 0,01
⇒ a = 0,002, b = 0,008 (mol)
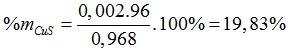
%mZnS =100% - 19,83% = 80,17%
Bài 14: Đun nóng 4,8 gam bột magie với 4,8 gam bột lưu huỳnh trong điều kiện không có không khí, thu được hỗn hợp rắn X. Hòa tan hoàn toàn X vào dung dịch HCl dư, thu được hỗn hợp khí Y. My = ?
A. 9 B. 13 C. 26 D. 5
Hướng dẫn giải:
Đáp án C.
Mg + S → MgS
MgS + 2HCl → MgCl2 + H2S
Mg + 2HCl → MgCl2 + H2
nMg = 0,2 (mol); nS = 0,15 (mol)
= nMgS = nS = 0,15 mol; = nMg (dư) = 0,2 – 0,15 = 0,05 (mol)
⇒ MY = (0,15.34+0,05.2)/(0,15+0,05)=26
Bài 15: Dẫn 1,12 lít (đktc) hỗn hợp khí X gồm O2 và O3 đi qua dung dịch KI dư, sau phản ứng thu được 6,35 gam chất rắn màu tím đen. Phần trăm thể tích của ozon trong X là
A. 50%. B. 25%. C. 75%. D. 80%.
Hướng dẫn giải:
Đáp án A.
nX = 0,05 (mol)
nI2=0,025 mol
O3 + 2KI + H2O → 2KOH + O2 + I2
0,025 ← 0,025 (mol)
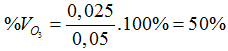
Bài 16: Hấp thụ 7,84 lít (đktc) khí H2S vào 64 gam dung dịch CuSO4 10%, sau phản ứng hoàn toàn thu được m gam kết tủa đen. Giá trị của m là:
A. 33,6. B. 38,4. C. 3,36. D. 3,84.
Hướng dẫn giải:
Đáp án D.
nH2S = 0,35 (mol),nCuSO4=(64,10)/(100.160)=0,04 mol
H2S + CuSO4 → CuS + H2SO4
0,35 0,04 0,04 (H2S dư)
m = 0,04.(64+32) = 3,84 (g)
Bài 17: Đốt cháy hoàn toàn V lít khí H2S (đktc) bằng một lượng oxi vừa đủ thu được khí Y. Hấp thụ hết Y cần vừa đủ 200 ml dung dịch KMnO4 1M. Giá trị của V là
A. 0,2. B. 4,48. C. 0,5. D. 11,2
Hướng dẫn giải:
Đáp án D.
nKMnO4=0,2 mol
2H2S + 3O2 → 2SO2 + 2H2O
0,5 0,5 (mol)
5SO2 + 2KMnO4 + 2H2O → 2H2SO4 + 2MnSO4 + K2SO4
0,5 0,2 (mol)
V = 0,5.22,4 =11,2 (lít)
Bài 18: Cho 5,6 lít (đktc) hỗn hợp khí X gồm H2S và SO2 tác dụng hết với 1,25 lít dung dịch nước brom vừa đủ. Thêm tiếp vào dung dịch sau phản ứng Ba(NO3)2 dư, thu được m gam kết tủa trắng. Giá trị của m là
A. 116,50. B. 29,125. C. 58,25. D. 291,25.
Hướng dẫn giải
Đáp án C
nkhí = 0,25 (mol)
nH2S = a(mol),nSO2 = b (mol)
H2S + 4Br2 + 4H2O → 8 HBr + H2SO4
a a
SO2 + Br2 + 2H2O → 2HBr + H2SO4
b b
H2SO4 + Ba(NO3)2 → BaSO4 + 2HNO3
a+b a+ b
m= 233.(a+b) = 233.0,25 = 58,35 g
Bài 19: Trộn 200 gam dung dịch H2SO4 12% với 300 gam dung dịch H2SO4 40% thu được 500 gam dung dịch H2SO4 a%. Giá trị của a là
A. 20,8%. B. 28,8%. C. 25,8%. D. 30,8%
Hướng dẫn giải
Đáp án B.
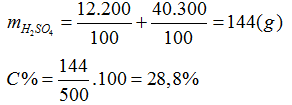
Bài 20: Lưu huỳnh tác dụng với dung dịch H2SO4 đặc nóng: S + H2SO4 → SO2 + H2O. Trong phản ứng này có tỉ lệ số nguyên tử S bị khử với số nguyên tử S bị oxi hoá là
A. 2:1. B. 1:2. C. 1:3. D. 3:1
Hướng dẫn giải:
Đáp án A.
S + 2H2SO4 → 3SO2 + 2H2O.
Bài 21: Hoà tan hoàn toàn m gam hỗn hợp X gồm Li2CO3, K2CO3, Na2CO3 trong dung dịch H2SO4 loãng, dư thu được dung dịch Y và 7,84 lít khí bay ra (đktc). Khi cô cạn dung dịch Y thu được 38,2 muối khan. Giá trị m là
A. 25,6. B. 50,8. C. 51,2. D. 25,4.
Hướng dẫn giải:
Đáp án A.
Gọi công thức của hỗn hợp X là: M2CO3
nCO2=0,25 mol
M2CO3 + H2SO4 → M2SO4 + H2O + CO2
0,35 0,35 0,35
Bảo toàn khối lượng: mX + maxit = m muối + m nước + m khí
m + 0,35.98 = 38,2 + 0,35.18 + 0,35.44
⇒ m = 25,6 (g)
Bài 22: Trong công nghiệp người ta sản xuất axít sunfuric theo sơ đồ sau:
FeS2 → SO2 → SO3 → H2SO4. Người ta sử dụng 15 tấn quặng pirit sắt (chứa 80% FeS2) để sản xuất ra 39,2 tấn dung dịch H2SO4 40%. Vậy hiệu suất chung cho cả quá trình sản xuất axít sunfuric từ quặng trên là
A. 40%. B. 60%. C. 80%. D. 62,5%
Hướng dẫn giải
Đáp án C.
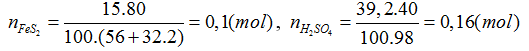
FeS2 → 2H2SO4
0,08 ← 0,16 (mol)
H% = 0,08.100/0,1= 80%
Bài 23: Hoà tan hoàn toàn 14,6 gam hỗn hợp kim loại X gồm Al, Zn bằng dung dịch H2SO4 đặc nóng thu được dung dịch Y và thoát ra 12,32 lít khí SO2 (đktc), sản phẩm khử duy nhất. Cô cạn cẩn thận dung dịch Y thu được m gam muối sunfat khan. Giá trị của m là
A. 118,7. B. 53,0. C. 100,6. D. 67,4.
Hướng dẫn giải
Đáp án D.
nSO2 = 0,55 ⇒ ne = 0,55.2 = 1,1 (mol)
mmuối = mKL + Mgốc axit. ne/2
= 14,6 + 96. 1,1/2 = 67,4 g
Bài 24: Hòa tan 18,4 gam hỗn hợp X gồm Fe và Cu trong dung dịch H2SO4 đặc, nóng dư thu được 7,84 lít SO2 (đktc) và dung dịch Y. Phần trăm khối lượng của Fe trong hỗn hợp X là
A. 60,87%. B. 45,65%. C. 53,26%. D. 30,43%.
Hướng dẫn giải:
Đáp án D.
Gọi nCu = y, nFe = x mol
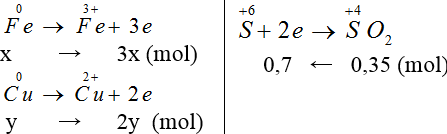
Áp dụng định luật bảo toàn e ta có: 3x+2y = 0,7 (1)
Khối lượng hai kim loại = 1,84 g: 56x+64y = 184 (2).
Giải 1,2 ta có: x = 0,1, y = 0,2 (mol)
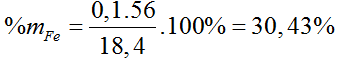
Bài 25: Cho hỗn hợp X gồm 0,08 mol mỗi kim loại Mg, Al, Zn vào dung dịch H2SO4 đặc, nóng, dư thu được 0,07 mol một sản phẩm khử duy nhất chứa lưu huỳnh. Xác định sản phẩm khử?
A. SO2. B. S. C. H2S. D. SO3.
Hướng dẫn giải
Đáp án C.
Bảo toàn e ta có
nMg.2 + nAl.3 + nZn.2 = nspk.x (x là số e thay đổi của sản phẩm khử)
0,08.2 + 0,08.3 + 0,08.2 = 0,07. x ⇒ x = 8 ⇒ Sản phẩm khử là H2S
Bài 26: Để hoà tan hoàn toàn 2,32 gam hỗn hợp gồm FeO, Fe3O4 và Fe2O3 (trong đó số mol FeO bằng số mol Fe2O3) cần dùng vừa đủ V lít dung dịch H2SO4 0,5M loãng. Giá trị của V là:
A. 0,23. B. 0,18. C. 0,08. D. 0,16.
Hướng dẫn giải:
Đáp án C.
Do số mol FeO bằng số mol Fe2O3,
Coi hỗn hợp chỉ có Fe3O4.
nFe3O4= 2,32/232=0,01 mol
Fe3O4 + 4H2SO4 → Fe2(SO4)3 + FeSO4 + 4H2O
0,01 0,04
V = 0,04/0,5 = 0,08 lít
Bài 27: Hoà tan hết 7,74 gam hỗn hợp bột Mg, Al bằng 500 ml dung dịch hỗn hợp HCl 1M và H2SO4 0,28M vừa đủ thu được dung dịch X . Cô cạn dung dịch X thu được lượng muối khan là:
A. 38,93 gam.
B. 103,85 gam.
C. 25,95 gam.
D. 77,86 gam.
Hướng dẫn giải
Đáp án A.
nHCl = 0,5 (mol), = 0,14 (mol)
mmuối = m KL + m gốc axit (Cl, SO4)
= 7,74 + 0,5.35,5 + 0,14.96 = 38,93 (g)
Bài 28: Hoà tan 19,2 gam kim loại M trong H2SO4 đặc dư thu được khí SO2. Cho khí này hấp thụ hoàn toàn trong NaOH dư, sau phản ứng đem cô can dung dịch thu được 37,8 gam chất rắn. Kim loại M là
A. Cu. B. Mg. C. Fe. D. Ca.
Hướng dẫn giải
Đáp án A.
Do NaOH dư nên có phản ứng
nNa2SO3= 0,3 (mol)
2NaOH + SO2 → Na2SO3 + H2O
0,3 0,3 (mol)
Gọi hóa trị của M là x
Bảo toàn e ta có nM.x =nSO2.2 ⇒ nM = 0,6/x
MM = 32x, Với x = 2, M = 64 (Cu)
Bài 29: Khi cho 9,6 gam Mg tác dụng hết với dung dịch H2SO4 đậm đặc, thấy có 49 gam H2SO4 tham gia phản ứng, tạo muối MgSO4, H2O và sản phẩm khử X. X là:
A. SO2. B. S. C. H2S. D. SO2, H2S.
Đáp án C
nH2SO4 = 0,5 (mol)
nMg = 0,4 (mol) = nMgSO4
Bảo toàn S: nH2SO4 ⇒ nMgSO4+nS (trong X) ⇒ n S (trong X) = 0,1.
Bảo toản e: nMg.2 = nx.a (a là số e X đã nhận) ⇒ a = 8
Vậy sản phẩm khử là H2S
Bài 30: Hòa tan hoàn toàn 2,52 gam hỗn hợp Mg và Al bằng dung dịch HCl thu được 2,688 lít hiđro (đktc). Cũng lượng hỗn hợp này nếu hòa tan hoàn toàn bằng H2SO4 đặc nóng thì thu được 0,12 mol một sản phẩm X duy nhất hình thành do sự khử S+6. X là:
A. S. B. SO2. C. H2S. D. S hoặc SO2.
Hướng dẫn giải:
Đáp án B.
nH2 = 0,12 (mol)
Gọi số mol Mg = a, Al = b (mol)
24a + 27b = 2,52
Bảo toàn e: nMg.2 + nAl.3 = .2
2a + 3b = 0,12.2
⇒ a = 0,06, b =0,04 (mol)
Phản ứng với H2SO4 đặc
Bảo toàn e: nMg.2 + nAl.3 = nX.a (a là số e X đã nhận)
⇒ a = 2 , sản phẩm khử là SO2.
Trên đây VnDoc đã giới thiệu tới các bạn lý thuyết Hóa học 10: Trắc nghiệm chương 6: Nhóm Oxi, Lưu huỳnh phần 9. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 10, Giải bài tập Hóa học lớp 10, Giải bài tập Vật Lí 10, Tài liệu học tập lớp 10 mà VnDoc tổng hợp và giới thiệu tới các bạn đọc.








