Trắc nghiệm chương 2: Bảng tuần hoàn các nguyên tố hóa học và Định luật tuần hoàn phần 5
Chuyên đề Hóa học lớp 10: Trắc nghiệm chương 2: Bảng tuần hoàn các nguyên tố hóa học và Định luật tuần hoàn phần 5 được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Bài tập trắc nghiệm chương 2
Bài 1: Độ âm điện của các nguyên tố: Na, Mg, Al, Si. Xếp theo chiều tăng dần là:
A. Na < Mg < Al < Si
B. Si < Al < Mg < Na
C. Si < Mg < Al < Na
D. Al < Na < Si < Mg
Chọn đáp án: A
Giải thích: Trong cùng 1 chu kì độ âm điện tăng dần theo chiều tăng của điện tích hạt nhân do đó Na < Mg < Al < Si
Bài 2: Các nguyên tố C, Si, Na, Mg được xếp theo thứ tự năng lượng ion hoá thứ nhất giảm dần là :
A. C, Mg, Si, Na
B. Si, C, Na, Mg
C. Si, C, Mg, Na
D. C, Si, Mg, Na
Chọn đáp án: D
Giải thích:
Trong cùng 1 nhóm năng lượng ion hoá thứ nhất giảm dần theo chiều tăng của điện tích hạt nhân do đó bán kính Si < C
Trong cùng 1 CK năng lượng ion hoá thứ nhất tăng dần theo chiều tăng của điện tích hạt nhân do đó bán kính Na < Mg < Si
Do đó thứ tự năng lượng ion hoá thứ nhất giảm dần là: C, Si, Mg, Na
Bài 3: Nguyên tử của nguyên tố A có tổng số electron ở phân lớp p là 5, Vị trí của nguyên tố A trong bảng tuần hoàn là
A. Nhóm VA, chu kì 3.
B. VIIA, chu kì 2.
C. VIIB, chu kì 2.
D. VIA, chu kì 3.
Chọn đáp án: B
Giải thích:
Cấu hình e của A là: 1s22s22p5
Có 2 lớp e: thuộc chu kì 2, có 7 e lớp ngoài cùng: thuộc nhóm VIIA.
Bài 4: Công thức của hợp chất khí với hidro của nguyên tố A là AH2 trong đó A chiếm 94,11%. Vậy A là:
A. Se B. O C. Te D. S
Chọn đáp án: D
Giải thích:
Ta có:![]() → A = 32 → A là lưu huỳnh (S)
→ A = 32 → A là lưu huỳnh (S)
Bài 5: Dãy gồm các ion X+, Y- và nguyên tử Z đều có cấu hình electron 1s22s22p6 là:
A. Na+, Cl- , Ar
B. Li+, F- , Ne
C. Na+, F- , Ne
D. K+, Cl- , Ar
Chọn đáp án: C
Giải thích:
X+: 1s22s22p6 → X: 1s22s22p63s1 → X là Na.
- Y-: 1s22s22p6 → X: 1s22s22p5 → Y là F.
- Z: 1s22s22p6 → Z là Ne.
Bài 6: Hai nguyên tố A và B thuộc cùng một chu kì và ở hai phân nhóm kế tiếp nhau trong bảng tuần hoàn, tổng số electron trong hai nguyên tử A và B là 25. Vậy cấu hình e của A và B tương ứng là:
A. 1s22s22p63s2 và 1s22s22p63s23p1
B. 1s22s22p63s23p3 và 1s22s22p63s1
C. 1s22s22p63s2 và 1s22s22p63s23p2
D. 1s22s22p63s1 và 1s22s22p63s23p2
Chọn đáp án: A
Giải thích:
Ta có: ZA + ZB = 25 và ZB – ZA = 1 ( Giả sử ZB > ZA)
→ ZA = 12; ZB = 13
Cấu hình A và B lần lượt là: 1s22s22p63s2 và 1s22s22p63s23p1
Bài 7: Phân tử X2Y có tổng số proton là 23. Biết X, Y ở hai nhóm A liên tiếp trong cùng một chu kì. Dựa vào cấu hình electron các nguyên tử X, Y. Tìm công thức phân tử và gọi tên hợp chất X2Y
A. NO2 B. CO2 C. H2S D. H2O
Chọn đáp án: A
Giải thích:
Đặt số proton của X, Y là ZX, ZY
Ta có 2ZX + ZY = 23 (1)
Nếu X trước Y thì ZY = ZX + 1 (2)
Từ (1) và (2) → 2ZX + ZX + 1 = 23 → ZX = 22/3=7,3 (vô lí)
Nếu Y trước X thì ZX = ZY + 1 (3)
Từ (1) và (3) → 2( ZY + 1) + ZY = 23 → 3ZY = 21
ZY = 7 → Y là nito (N)
ZX = 8 → X là oxi (O)
Công thức X2Y là NO2
Bài 8: Để hòa tan hoàn toàn 6,4 gam hỗn hợp kim loại R (chỉ có hóa trị II) và oxit của nó cần vừa đủ 400ml dung dịch HCl 1M. Tìm kim loại R.
A. Ca B. Mg C. Ba D. Be
Chọn đáp án: B
Giải thích:
R + HCl → RCl2 + H2
RO + 2HCl → RCl2 + H2O
Ta có: nHCl =0,4.1 = 0,4 mol → n(R,RO)=0,2 mol → M−=6,4/0,2 =32
Theo tính chất của M− ta có: M < 32 < M + 16 → 16 < M < 32
→ M = 24 (Mg) là nghiệm hợp lí.
Bài 9: Nguyên tử của nguyên tố C có cấu hình electron lớp ngoài cùng là ns2np4. Trong hợp chất khí của X với hidro, X chiếm 94,12% khối lượng. Phần trăm khối lượng của nguyên tố X trong oxit cao nhất là:
A. 50% B. 27,27% C. 60% D. 40%
Chọn đáp án: D
Giải thích:
X: ns2np4 → X thuộc nhóm IVA → hợp chất khí với H là XH2 → oxit cao nhất là XO3.
Ta có:![]() → MX = 32 (đvC)
→ MX = 32 (đvC)
→ %X trong oxit cao nhất = 32/(32+16.3 ). 100% = 40%
Bài 10: X, Y, Z là ba kim loại liên tiếp nhau trong một chu kì. Tổng số khối của chúng là 74. Xác định X, Y, Z.
A. Na, Mg, Al
B. Li, Na, K
C. Be, Mg, Ba
D. Li, Be, B
Chọn đáp án: A
Giải thích:
Vì ba kim loại liên tiếp nhau trong cùng một chu kì nên số proton của X, Y, Z lần lượt là p, p+1, p+2, do đó tổng số proton của kim loại là:
p + (p+1) + (p+2) = 3p + 3
Ta có: 3p + 3 + (n1 + n2 + n3) = 74
3p + 3 ≤ n1 + n2 + n3 ≤ 1,5(3p + 3) → 8,8 ≤ p ≤ 11,3
| P | 9 | 10 | 11 |
|---|---|---|---|
| Nguyên tố | F | Ar | Na |
Vì X, Y, Z là kim loại nên ta nhận p =11 là kim loại Na.
Ba kim loại liên tiếp trong cùng một chu kì nên X: Na, Y: Mg, Z: Al
Bài 11: Hòa tan hết a gam oxit kim loại M (thuộc nhóm IIA) bằng một lượng vừa đủ dung dịch H2SO4 17,5% thu được dung dịch muối có nồng độ 20%. Xác định công thức oxit kim loại M.
A. BaO B. MgO C. CaO D. BeO
Chọn đáp án: B
Giải thích:
Gọi số mol oxit MO = x mol.
MO + H2SO4 → MSO4 + H2O
(mol): x x x
Ta có: (M + 16)x = a
Khối lượng dung dịch axit H2SO4 ban đầu = (98x.100)/17,5=560x (gam).
Khối lượng dung dịch sau phản ứng = a + 560x = (M + 16)x + 560x.
Theo bài: C% (MSO4) = 20% nên:![]()
Từ đây ta tìm được M = 24 (magie). Oxit kim loại cần tìm là MgO.
Bài 12: Cho các nguyên tố M (Z = 11), X (Z = 17), Y (Z = 9) và R (Z = 19). Độ âm điện của các nguyên tố tăng dần theo thứ tự
A. M < X < Y < R
B. R < M < X < Y
C. Y < M < X < Z
D. M < X < R < Y
Chọn đáp án: B
Giải thích:
M (Z = 11): [Ne]3s1; X (Z = 17): [Ne]3s23p5
R (Z = 19): [Ar]4s1; Y (Z = 9): 1s22s22p5
Ta thấy: - M và R cùng nhóm IA
- X và Y cùng nhóm VIIA
- M và X cùng chu kì 3
Mà trong 1 nhóm A, đi từ trên xuống dưới độ âm điện giảm dần.
Trong 1 chu kì, đi từ trái sang phải độ âm điện tăng dần.
→ độ âm điện: R < M < X < Y
Bài 13: Oxit của A có công thức hóa học AxOy là hợp chất khí, trong đó oxi chiếm 69,57% về khối lượng. Biết rằng 5,6 lít khí này ở đktc có khối lượng là 11,5 gam. Cho các phát biểu sau:
(1) Nguyên tố A thuộc chu kì 2 của bảng tuần hoàn.
(2) A là phi kim.
(3) A có độ âm điện lớn hơn oxi.
(4) Bán kính nguyên tử của A nhỏ hơn P.
(5) Hợp chất AxOy ở trên là oxit ứng với hóa trị cao nhất của A.
Trong các phát biểu trên, số phát biểu đúng là
A. 1 B. 2 C. 3 D. 4
Chọn đáp án: C
Giải thích:
![]() ⇒ A.x = 7y (1)
⇒ A.x = 7y (1)
M=11,5/(5,6/22,4)= 46 ⇒ A.x + 16.y = 46 (2)
Từ (1) và (2) ⇒ y=2 ⇒ A.x =14
Với x=1 thỏa mãn A=14 (N) ⇒ Hợp AxOy là NO2.
Các phát biểu 1, 2 ,4 đúng.
Bài 14: Nguyên tử X tạo được Anion X2-. Cấu hình e của X2- ở trạng thái cơ bản là 3s23p6. Tổng số hạt mang điện trong nhân của X là.
A. 18 B. 16 C. 38 D. 19
Chọn đáp án: B
Giải thích:
Cấu hình của X2- là 3s23p6
⇒ R sẽ là 3s23p4
⇒ R có cấu hình đầy đủ là 1s22s22p63s23p4
⇒ Tổng hạt mang điện trong nhân của X là p = 16
Bài 15: Cho 10,2 gam hỗn hợp hai kim loại thuộc nhóm IA và ở hai chu kì liên tiếp trong bảng tuần hoàn, tác dụng với H2O dư thu được 5,6 lít khí H2 (đktc). Xác định tên của hai kim loại đem dùng.
A. Li, Na B. Na, K C. Li, Be D. Li, K
Chọn đáp án: A
Giải thích:
Gọi kim loại thuộc hai chu kì liên tiếp và thuộc nhóm IA là: X và Y (MX < MY).
Gọi kim loại chung của hai kim loại này là : A−
2A− + 2H2O → 2A ̅OH + H2 ↑ (1)
(mol) 0, 5 ← 0, 25
Ta có: nH2 = 5,6/22,4 = 0,25 (mol). Từ (1) ⇒ nA = 0,5(mol)
MA = 10,2/0,5= 20, 4 ⇒ MX < MA = 20, 4 < MY
Vậy X là Li (M = 7) và Y là Na ( M=23)
Bài 16: X và Y là hai nguyền tố thuộc hai chu kì liên tiếp nhau và cùng thuộc một nhóm A, trong đó X có điện tích hạt nhân nhỏ hơn Y. Tổng số proton trong hạt nhân nguyên tử của X và Y là 22. Xác định hai nguyên tố X, Y.
A. P và C B. O và S C. N và P D. F và Cl
Chọn đáp án: C
Giải thích:
Theo đề bài, ta có: ZX + ZY = 22 (1)
- Nếu X, Y thuộc hai chu kì nhỏ thì (ZX < ZY): ZY = ZX + 8 (2)
Từ (1) và (2) ⇒ ZX =7; ZY = 15.
Vậy X là N, Y là P.
- Nếu X thuộc chu kì nhỏ và Y thuộc chu kì lớn thì: ZY = ZX + 18 (3)
Từ (1) và (3) ⇒ ZX = 2; ZY = 20 (loại vì không thảo mãn đề bài).
- Nếu X, Y thuộc hai chu kì lớn: ZY = ZX + 32 (4)
Từ (1) và (4) ⇒ ZX < 0 (loại)
Bài 17: M là kim loại thuộc nhóm IIA. Hòa tan hết 10,8 gam hỗn hợp kim loại muối cacbonat của nó trong dung dịch HCl, thu được 4,48 lít hỗn hợp khí A (đktc). Tỷ khối của A so với khí hidro là 11,5. Tìm kim loại M
A. Ca B. Mg C. Ba D. Be
Chọn đáp án: B
Giải thích:
Gọi số mol các chất trong hỗn hợp đầu: M = a mol; MCO3 = b mol.
M + 2HCl → MCl2 + H2↑ (1)
(mol): a a
MCO3 + 2HCl → MCl2 + CO2 + H2O (2)
(mol): b b
Số mol A = 4,48/22,4=0,2 nên a + b = 0,2 (3)
MA = 11,5 x 2 = 23 nên (2a+44b)/(a+b) = 23 hay 2a + 44b =4,6 (4)
Theo bài: Ma + (M + 60)b = 10,8 (5)
Từ (3), (4), (5) ta tìm được: a = 0,1 mol, b = 0,1 mol, M = 24 (Mg)
Bài 18: Trong 20 nguyên tố hóa học đầu tiên trong bảng tuần hoàn, số nguyên tố có nguyên tử với 2 electron độc thân ở trạng thái cơ bản là
A. 1 B. 3 C. 2 D. 4
Chọn đáp án: D
Giải thích:
Chu kì 2 có 2 nguyên tố có 2 electron độc thân trong nguyên tử là
C: 1s22s22p2
O: 1s22s22p4
Chu kì 3 có 2 nguyên tố có 2 electron độc thân trong nguyên tử là
Si: 1s22s22p63s23p2
S: 1s22s22p63s23p4
Bài 19: Cho 6,4 g hỗn hợp hai kim loại nhóm IIA, thuộc hai chu kì liên tiếp, tác dụng hết với dung dịch HCl dư thu được 4,48 lít khí hiđro (đktc). Các kim loại đó là
A. Be và Mg
B. Mg và Ca
C. Ca và Sr
D. Sr và Ba
Chọn đáp án: B
Giải thích:
Áp dụng phương pháp khối lượng mol trung bình, ta có
M= 6,4/0,2 = 32
→ 24= M1 < 32 < M2 = 40
Bài 20: Hai nguyên tố A, B đứng kế tiếp nhau trong một chu kì của bảng tuần hoàn có tổng số đơn vị điện tích hạt nhân là 25. Xác định tên 2 nguyên tố
A. Al, Mg B. Na, Mg C. K, Ca D. Na, K
Chọn đáp án: A
Giải thích:
Gọi số điện tích hạt nhân của nguyên tố A là ZA, số điện tích hạt nhân của nguyên tố B là ZB. Theo đề bài ta có
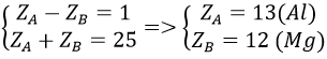
Bài 21: Cho công thức oxit cao nhất của nguyên tố R là RO2, trong hợp chất khí của R với hidro, R chiếm 94,81% khối lượng. Xác định R biết MO = 16 và MH = 1
A. C B. Ge C. S D. N
Chọn đáp án: B
Giải thích:
Công thức oxit cao nhất là RO2 → R thuộc nhóm IVA
→ Công thức hợp chất khí của R là RH4
Trong hợp chất khí của R, R chiếm 94,81% khối lượng
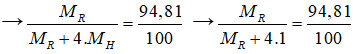
→ MR=73(gam/mol)
MR = 73 (gam/mol) → R là Ge
Bài 22: Cho X,Y và T là ba nguyên tố liên tiếp trong 1 chu kì, tổng số hạt p của các hợp chất XH3, YO2 và T2O7 là 140 hạt. Xác định Y biết ZT > ZY > ZX và ZH = 1; ZO = 8.
A. S B. C C. N D. H
Chọn đáp án: A
Giải thích:
Tổng số hạt p của các hợp chất XH3, YO2 và T2O7 là 140 hạt
→ ZX + 3ZH + ZY + 2ZO + 2ZT + 7ZO = 140 (1)
→ ZX + 3.1 + ZY + 2.8 + 2ZT + 7.8 = 140
→ ZX + ZY + 2ZT = 65 (1)
Cho X, Y và T là ba nguyên tố liên tiếp trong 1 chu kì và ZT > ZY > ZX
→ ZY = ZX +1 (2)
ZT = ZY+1 = ZX + 2 (3)
Thay (2) và (3) vào (1) ta có
ZX + ZX + 1 + 2.(ZX + 2) = 65
ZX = 15 → X là P
ZY = 16 → Y là S
ZT= 17 → T là Cl
Bài 23: Cho X và Y là hai nguyên tố thuộc cùng nhóm và hai chu kì liên tiếp, tổng số hạt p của X và Y là 18 hạt. Xác định X và Y biết ZX > ZY.
A. Al và B B. Na và Mg
C. K và Ca D. Al và Ga
Chọn đáp án: A
Giải thích:
X và Y là hai nguyên tố ở hai chu kì liên tiếp và cùng 1 nhóm
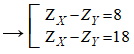
Tổng số hạt p của X và Y là 18 → ZX + ZY = 18
TH1:![]()
ZY = 5 → Cấu hình electron nguyên tử 1s22s22p1 ở nhóm IIIA, chu kì 2
ZX = 13 → Cấu hình electron nguyên tử 1s22s2s2p63s23p1 ở nhóm IIIA, chu kì 3 (TM)
TH2:![]()
Vậy X và Y lần lượt là Al và B
Bài 24: Oxit cao nhất của nguyên tố R là R2O5. Trong hợp chất khí với hidro, R chiếm 96,15% về khối lượng, xác định nguyên tử khối của R.
A. N B. Cl C. P D. As
Chọn đáp án: D
Giải thích:
Oxit của R là R2O5 ⇒ R thuộc nhóm VA . Hợp chất của R với hiđro có công thức: RH3
Theo đề ta có:
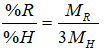
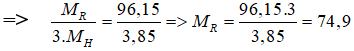
⇒ R là Asen (As)
Bài 25: Hòa tan 19,5 gam kim loại trong nhóm IA trong Vml dung dịch HCl 0,1M thu được 5,6 lít khí (đktc). Xác định tên kim loại.
A. K B. Li C. Na D. Ca
Chọn đáp án: A
Giải thích:
2R + 2HCl → 2RCl + H2
Ta có: nH2 = 0,25 mol ⇒ nR =0,25 .2 = 0,05 mol
⇒ MR =19,5/0,5 = 39
Vậy R là nguyên tố K
Bài 26: Nguyên tử R tạo được cation R3+. Cấu hình electron ở phân lớp ngoài cùng của R3+ (ở trạng thái cơ bản) là 2p6. Tổng số hạt mang điện trong nguyên tử R là
A. 10 B. 11 C. 22 D. 26
Chọn đáp án: C
Giải thích:
Cấu hình electron ở phân lớp ngoài cùng của R3+ (ở trạng thái cơ bản) là 2p6
→ Cấu hình electron của R là 1s22s22p63s23p1
→ R có p = e =13
→ tổng số hạt mang điện trong nguyên tử R là : p+e= 13+13=26
Bài 27: Bán kính nguyên tử các nguyên tố: Mg, Si, C, N. Xếp theo chiều tăng dần là:
A. Mg < C< Si < N
B. Mg < C < Si < N
C. N < C < Si < Mg
D. C < N < Si < Mg
Chọn đáp án: C
Giải thích:
Trong cùng 1 nhóm bán kính nguyên tử tăng dần theo chiều tăng của điện tích hạt nhân do đó bán kính C < Si
Trong cùng 1 CK bán kính kim loại giảm dần theo chiều tăng của điện tích hạt nhân do đó bán kính N < C; Si < Mg
⇒ Bán kính nguyên tử tăng dần: N < C < Si < Mg
Bài 28: R thuộc chu kì 3 nhóm VA của bảng tuần hoàn. Cho biết cấu hình electron của R có bao nhiêu electron p?
A. 3 B. 4 C. 9 D. 6
Chọn đáp án: C
Giải thích:
R thuộc chu kì 3 ⇒ Có 3 lớp electron.
R thuộc nhóm VA ⇒ Có 5 electron lớp ngoài cùng
⇒ Cấu hình electron của R: 1s22s22p63s23p3 ⇒ có 9 e thuộc phân lớp p
Bài 29: Cấu hình electron ở trạng thái cơ bản của nguyên tử nguyên tố X có tổng số electron trong các phân lớp p là 8. Nguyên tố X là
A. O (Z=8) B. Cl (Z=17) C. Al (Z=13) D. Si (Z=14)
Chọn đáp án: D
Giải thích:
Cấu hình electron ở trạng thái cơ bản của nguyên tử nguyên tố X có tổng số electron trong các phân lớp p là 8
→ X có 6 electron ở phân lớp 2p và 2 electron ở phân lớp 3p
→ Cấu hình electron của X là 1s22s22p63s23p2
→ Z=14 → X là Si
Bài 30: Biết tổng số electron trong nguyên tử M là 16e, cấu hình e lớp ngoài cùng của M là ns2np4. M thuộc chu kì mấy
A. Chu kì 3
B. Chu kì 4
C. Chu kì 2
D. Chu kì 5
Chọn đáp án: A
Giải thích:
Cấu hình e của M là ns2np4 ⇒ M có 6 e lớp ngoài cùng
Tổng số e trong M = 16= 2+8 + 6 ⇒ Cấu hình e của M: 1s22s22p63s23p4
⇒ M thuộc chu kì 3
Bài 31: Nguyên tử của nguyên tố X có cấu hình electron lớp ngoài cùng là ns2np4. Trong hợp chất khí của nguyên tố X với hidro, X chiếm 94,12% khối lượng. Phần trăm khối lượng của nguyên tố X trong oxit cao nhất là
A. 50% B. 27,27% C. 60% D. 40%
Chọn đáp án: D
Giải thích:
X có cấu hình electron lớp ngoài cùng là ns2np4 → hợp chất khí của X với H là XH2
Trong XH2, X chiếm 94,12% về khối lượng nên ta có
X/(X+2)100% = 94,12% → X= 32 → X là Lưu huỳnh
Oxit cao nhất của S là SO3 → %S = (32/80)100% = 40%
Bài 32: Cho biết cấu hình electron lớp ngoài cùng của nguyên tử nguyên tố (thuộc chu kỳ 4) M là ns2. Xác định M
A. Mg B. Ca C. Na D. B
Chọn đáp án: B
Giải thích:
M thuộc chu kì 4 nên có n = 4.
Cấu hình electron M: 1s22s22p63s23p64s2 (ô số 20, nhóm IIA), M là kim loại Ca.
Bài 33: Trong bảng tuần hoàn các nguyên tố hóa học, nguyên tố X ở nhóm IA, nguyên tố Y ở nhóm VIA. Công thức của hợp chất tạo thành từ 2 nguyên tố trên có dạng là
A. X2Y3 B. X2Y C. XY D. X5Y2
Chọn đáp án: B
Giải thích:
Do X dễ nhường 1 electron để đạt cấu hình bền vững → X có số oxi hóa +1
Y dễ nhận 2 electron để đạt cấu hình bền vững → Y có số oxi hóa -2
→ Công thức phù hợp là X2Y
Bài 34: Cho 8,5g hỗn hợp hai kim loại kiềm (nằm ở hai chu kỳ liên tiếp) tác dụng với 100g H2O thoát ra 3,36 l khí ở (đktc). Xác định tên hai kim loại kiềm?
A. Li, Na B. Na, K C. K, Rb D. Li, K
Chọn đáp án: B
Giải thích:
Gọi công thức hóa trị trung bình của hai kim loại kiềm trên là R−.
PTHH: 2R− + 2H2O → 2R−OH + H2
nH2 = 3,36/22,4 =0,15 ⇔ nR− = 0,3
MR− = 8,5/0,3 = 28,3
23 < 28,3 < 39
(Na) (K)
Bài 35: Một nguyên tố R tạo được hợp chất khí với Hidro có công thức là RH3. Trong Oxit cao nhất của R, nguyên tố Oxi chiếm 74,07 % về khối lượng. Xác định R
A. N B. P C. As D. Si
Chọn đáp án: A
Giải thích:
%R = 100% - %O = 100% - 74,07% = 25,93%.
Hợp chất khí với Hidro là RH3 ⇒ b = 3
a + b = 8 ⇒ a = 5
Công thức Oxit cao nhất là R2O5
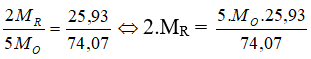
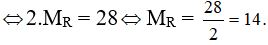
⇒ R là Nitơ.
Trên đây VnDoc đã giới thiệu tới các bạn lý thuyết Hóa học 10: Trắc nghiệm chương 2: Bảng tuần hoàn các nguyên tố hóa học và Định luật tuần hoàn phần 5. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 10, Giải bài tập Hóa học lớp 10, Giải bài tập Vật Lí 10, Tài liệu học tập lớp 10 mà VnDoc tổng hợp và giới thiệu tới các bạn đọc.








