Trắc nghiệm chương 5: Nhóm Halogen phần 1
Chuyên đề Hóa học lớp 10: Trắc nghiệm chương 5: Nhóm Halogen phần 1 được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Bài tập trắc nghiệm chương 5
Câu 1: Cấu hình e lớp ngoài cùng của các nguyên tử các nguyên tố halogen là:
A. ns2np4. B. ns2p5. C. ns2np3. D. ns2np6.
Đáp án B
Câu 2: Liên kết trong các phân tử đơn chất halogen là gì?
A. công hóa trị không cực.
B. cộng hóa trị có cực.
C. liên kết ion.
D. liên kết cho nhận.
Đáp án A
Câu 3: Chất nào có tính khử mạnh nhất?
A. HI. B. HF. C. HBr. D. HCl.
Đáp án A
Câu 4: Trong phản ứng clo với nước, clo là chất:
A. oxi hóa. B. khử.
C. vừa oxi hóa, vừa khử. D. không oxi hóa, khử.
Đáp án C
Câu 5: Cho dãy axit: HF, HCl, HBr, HI. Theo chiều từ trái sang phải tính chất axit biến đổi như sau:
A. giảm. B. tăng.
C. vừa tăng, vừa giảm. D. Không tăng, không giảm.
Đáp án B
Câu 6: Hãy lựa chọn phương pháp điều chế khí hidroclorua trong phòng thí nghiệm:
A. Thủy phân AlCl3. B. Tổng hợp từ H2 và Cl2.
C. clo tác dụng với H2O. D. NaCl tinh thể và H2SO4 đặc.
Đáp án D
Câu 7: Axit không thể đựng trong bình thủy tinh là:
A. HNO3 B. HF. C. H2SO4. D. HCl.
Đáp án B
Câu 8: Dung dịch AgNO3không phản ứng với dung dịch nào sau đây?
A. NaCl B. NaBr. C. NaI. D. NaF.
Đáp án D
Câu 9: Đặc điểm nào không phải là đặc điểm chung của các halogen?
A. Đều là chất khí ở điều kiện thường.
B. Đều có tính oxi hóa mạnh.
C. Tác dụng với hầu hết các kim loại và phi kim.
D. Khả năng t/d với nước giảm dần từ F2 đến I2.
Đáp án A
Câu 10. Trong phương trình MnO2 + HCl → MnCl2 + Cl2 + H2O thì hệ số cân bằng của HCl là bao nhiêu?
A. 1. B. 2 . C. 3. D. 4.
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
Đáp án D
Câu 11: Trong các kim loại sau đây, kim loại nào khi tác dụng với clo và axit clohidric cho cùng một loại muối?
A. Zn. B. Fe. C. Cu. D. Ag
Đáp án A
Câu 12: Dãy các chất nào sau đây đều tác dụng với axit clohidric?
A. Fe2O3, KMnO4, Cu, Fe, AgNO3.
B. Fe2O3,KMnO4¸Fe,CuO, AgNO3.
C. Fe, CuO, H2SO4, Ag, Mg(OH) 2.
D.KMnO4,Cu,Fe,H2SO4, Mg(OH) 2.
Đáp án B
Câu 13: Phản ứng nào chứng tỏ HCl là chất khử?
A. HCl + NaOH → NaCl + H2O.
B. 2HCl + Mg MgCl2+ H2 .
C. MnO2+ 4 HCl → MnCl2+ Cl2+ 2H2O.
D. NH3+ HCl → NH4Cl.
Đáp án C
Câu 14: Những hiđro halogenua có thể thu được khi cho H2SO4 đặc lần lượt tác dụng với các muối NaF, NaCl, NaBr, NaI là
A. HF, HCl, HBr, HI.
B. HF, HCl, HBr và một phần HI
C. HF, HCl, HBr.
D. HF, HCl.
2NaF + H2SO4 → Na2SO4 + 2HF
2NaCl + H2SO4 → Na2SO4 + 2HCl
2NaBr + 2H2SO4 → Na2SO4 + Br2 + SO2 + 2H2O
8NaI + 5H2SO4 → 4Na2SO4 + 4I2 + H2S + 4H2O
Đáp án D
Câu 15: Brom bị lẫn tạp chất là Clo. Cách nào sau đây có thể thu được brom tinh khiết?
A. Dẫn hỗn hợp khí đi qua dung dịch NaOH
B. Dẫn hỗn hợp khí đi qua dung dịch nước
C. Dẫn hỗn hợp khí đi qua dung dịch NaBr
D. Dẫn hỗn hợp khí đi qua dung dịch NaI.
Đáp án C
Câu 16: Trình bày phương pháp hóa học nhận biết các dung dịch sau: NaNO3, NaOH, Na2SO4, NaCl, HCl, H2SO4
Trích mỗi dung dịch một ít làm mẫu thử:
Cho quì tím lần lượt vào các mẫu thử trên:
- Mẫu thử làm quì tím hóa xanh là dung dịch NaOH
- Mẫu thử làm quì tím hóa đỏ là dung dịch HCl và H2SO4 (nhóm 1)
- Mẫu thử không làm đổi màu quì tím là NaNO3, Na2SO4 , NaCl (nhóm 2)
Cho dung dịch BaCl2 hoặc dung dịch Ba(NO3)2 hoặc dung dịch Ba(OH) 2 hoặc BaO lần lượt vào hai chất ở nhóm 1
- Mẫu thử tạo kết tủa trắng là H2SO4
BaCl2 + H2SO4 → BaSO4 ↓ + 2HCl
- Còn lại là dung dịch HCl
Cho dung dịch BaCl2 hoặc dung dịch Ba(NO3)2 hoặc dung dịch Ba(OH) 2 lần lượt vào hai chất ở nhóm 2.
- Mẫu thử nào tọa kết tủa trắng là Na2SO4
BaCl2 + H2SO4 → BaSO4 ↓ + 2HCl
- Hai mẫu thử còn lại không có hiện tượng gì
Cho dung dịch AgNO3 lần lượt vào hai mẫu thử còn lại. Mẫu thử nào kết tủa trắng là NaCl, còn lại là NaNO3
AgNO3 + NaCl → AgCl↓ + NaNO3
Câu 17: Chỉ dùng một hóa chất làm thuốc thử, nhận biết các dung dịch BaCl2, Zn(NO3)2, Na2CO3, AgNO3
Chọn thuốc thử là dung dịch HCl:
- Lần lượt nhỏ dung dịch HCl vào các mẫu thử đựng trong 5 ống nghiệm riêng biệt.
- Mẫu thử có khí sùi bọt là Na2CO3:
2HCl + Na2CO3 → 2NaCl + CO2 ↑+ H2O
- Mẫu thử tạo kết tảu trắng ra ngoài ánh sáng hóa đen là AgNO3
AgNO3 + HCl → AgCl↓ + HNO3
2AgCl → 2Ag + Cl2
- 3 mẫu thử còn lại BaCl2, Zn(NO3)2, HBr không thấy hiện tượng
Dùng AgNO3 vừa nhận biết để nhận ra 3 mẫu thử còn lại BaCl2, Zn(NO3) 2, HBr
- Mẫu thử tạo kết tủa trắng là BaCl2
2AgNO3 + BaCl2 → 2AgCl↓ + Ba(NO3) 2
- Mẫu thử tạo kết tủa vàng nhạt là HBr:
AgNO3 + HBr → AgBr↓ + HNO3
- Mẫu thử không có hiện tượng gì là Zn(NO3)2
Câu 18: Tinh chế NaCl có lần NaBr, NaI, Na2CO3
Hòa tan hỗn hợp vào nước tạo dung dịch hỗn hợp NaCl, NaBr, NaI, Na2CO3
- Thổi khí HCl vào chỉ có Na2CO3 phản ứng:
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
- Thổi tiếp Cl2 (có dư) vào:
2NaBr + Cl2 → 2NaCl + Br2
2NaI + Cl2 → 2NaCl + I2
- Cô cạn dung dịch H2O, Br2, I2 bay hơi hết còn lại NaCl nguyên chất
Câu 19: Cho dãy các chất sau, chất nào có khả năng tác dụng với Clo? Viết phương trình hóa học của phản ứng xảy ra, ghi rõ điều kiện phản ứng: Fe2O3, Fe, FeCl2, CuO, NaOH, H2S, NaBr, NaI.
Các chất có khả năng phản ứng với Cl là: Fe, FeCl2, NaOH, H2S, NaBr, NaIv
PTHH:
1, Fe + Cl2 → FeCl3
2, FeCl2 + Cl2 → FeCl3
3, 2NaOH + Cl2 → NaCl + NaClO + H2O
4, 4Cl2 + H2S + 4H2O → 8HCl + H2SO4
5, Cl2+ 2NaBr → 2NaCl + Br2
6, Cl2 + 2NaI → 2NaCl + I2)
Câu 20: Hãy biểu diễn sơ đồ biến đổi các chất sau bằng phương trình hoá học:
1. NaCl + H2SO4 → Khí (A) + (B)
2. (A) + MnO2 → Khí (C) + rắn (D) + (E)
3. (C) + NaBr → (F) + (G)
4. (F) + NaI → (H) + (I)
5. (G) + AgNO3 → (J) + (K)
6. (A) + NaOH → (G) + (E)
(A) là HCl , (B) là Na2SO4, (C) là Cl2, (D)là MnCl2, (E) là H2O, (F) là Br2, (G) là NaCl, (H)là I2, (I) là NaBr, (J) là AgCl, (K) là NaNO3.
Câu 21: Xác định A, B, C, D và hoàn thành các phương trình phản ứng sau:
1. MnO2 + (A) → MnCl2 + (B)↑ + (C)
2. (B) + H2 → (A)
3. (A) + (D) → FeCl2 + H2
4. (B) + (D) → FeCl3
5. (B) + (C) → (A) + HClO
(A): HCl, (B): Cl2, (C): H2 O, (D): Fe.
Câu 22: Hoà tan V lít khí HCl (đktc) vào 185,4 gam dung dịch HCl 10% thu được dung dịch HCl 16,57%. Giá trị của V là
A. 4,48. B. 8,96. C. 2,24. D. 6,72.
Đáp án B
Sử dụng PP đường chéo coi nồng độ HCl dạng khí là 100% tính được mHCl= 14,6g từ đó suy ra V
Câu 23: Phương pháp để điều chế khí F2 trong công nghiệp là:
A. oxi hóa muối florua.
B. dùng halogen khác đẩy flo ra khỏi muối.
C. điện phân hỗn hợp KF và HF ở thể lỏng.
D. không có phương pháp nào.
Đáp án C
Câu 24: Số oxi hóa của brom trong các hợp chất HBr, HBrO, KBrO3, BrF3 lần lượt là:
A. -1, +1, +1, +3. B. -1, +1, +2, +3.
C. -1, +1, +5, +3. D. +1, +1, +5, +3.
Đáp án C
Câu 25: Khi cho m (g) kim loại canxi tác dụng hoàn toàn với 17,92 lít khí X2 (đktc) thì thu được 88,8g muối halogenua.
a) Viết PTPƯ dạng tổng quát.
b) Xác định công thức chất khí X2 đã dùng.
c) Tính giá trị m.
a. PTHH: Ca + X2 → CaX2
b. Theo bài ta có: n X2 = 17,92/22,4 = 0,8 mol
nX2 = 88,8/(40+2.X)=0,8 Giải PT ta được X= 35,5 (Cl)
c. nCa = nX2 =0,8 ⇒MCa =40.0,8 = 32g)
Câu 26: Cho 16,15 gam dung dịch A gồm hai muối NaX, NaY (X, Y là hai halogen liên tiếp) tác dụng với dung dịch AgNO3 dư thu được 33,15 gam kết tủa trắng. X và Y lần lượt là:
A. F và Cl B. Cl và Br C. Br và I D. Cl và I
Đáp án B
Áp dụng PP tăng giảm khối lượng ⇒ nA = (33,15-16,15)/(108-23)= 0,2 mol ⇒ MA =80,75⇒ (X,Y) =57,75 ⇒ X, Y là Cl và Br.
Câu 27. Cho 26,1 g MnO2 tác dụng với dung dịch HCl dư thu được 6,048 lít Cl2 (ở đktc).Tính hiệu suất của phản ứng.
A. 80%; B. 90% C. 100% D.95%
Đáp án B
MnO2 + 4HCl → MnCl2 + Cl2 ↑ + 2H2 O
nMnO2= 26,1/87 = 0,3 mol . Theo pt: nCl2 = nMnO2 = 0,3 mol
Theo bài nCl2 = 6,048/22,4 = 0,27 mol ⇒ H = 0,27/0,3 = 90%.
Câu 28: Hòa tan 16 g oxit của kim loại X hóa trị III cần dùng 109,5 g dung dịch HCl 20%. Xác định tên X.
A. Al B. Fe C. Cr D.Mg
Đáp án B
PTHH: X2 O3 + 6HCl → 2XCl3 + 3H2 O
nHCl = 109,5/36,6 .20% = 0,6 mol ⇒ nX2O3 = 0,6/6= 0,1 mol
MX2O3 = 16/0,1 = 160 ⇒ MX = 56 (Fe).
Câu 29: Hòa tan 27,6g muối R2 CO3 vào một lượng dung dịch HCl 2M thu được 29,8 g muối. Xác định tên R và thể tích dung dịch HCl đã dùng.
A. K; 2M B. Na; 2M C. K; 0,2M D. Na; 0,2 M
Đáp án C
R2 CO3 + 2HCl → RCl2 + CO2 + H2 O
Áp dụng PP tăng giảm khối lượng ⇒ nR2CO3 = (29,8 -27,6) /(71-60) = 0,2 mol
⇒ MR2CO3 = 27,6/0,2 = 138 ⇒ MR = 39 (K)
Theo Pt: nHCl = 2. NR2CO3 = 0,4 mol ⇒ CM -(HCl) = 0,4/2 =0,2 M
Câu 30: Hoà tan hoàn toàn 25,12 gam hỗn hợp Mg, Al, Fe trong dung dịch HCl dư thu được 13,44 lít khí H2 (đktc) và m gam muối. Giá trị của m là
A. 67,72. B. 46,42. C. 68,92 D. 47,02.
Đáp án A
nH2 = 0,6 mol ⇒ nHCl = 0,6 .2 =1,2 mol
M Muối = mKL + mCl- = 25,12 + 1,2 . 35,5 = 67,72g
Câu 31. Hòa tan 1,74 gam MnO2 trong 200ml axit clohiđric 2M. Tính nồng độ (mol/l) của HCl và MnCl2 trong dung dịch sau khi phản ứng kết thúc. Giả thiết khí clo thoát hoàn khỏi dung dịch và thể tích của dung dịch không biến đổi.
MnO2 + 4HCl → MnCl2 + Cl2↑ + 2H2O
0,02 0,08 0,02 mol
Số mol MnO2 đã được hòa tan trong axit clohidric là: 1,74/87 = 0,02 mol
Số mol HCl có trong dung dịch là: (2 ×200)/1000 = 0,4 mol
Số mol HCl còn lại trong dung dịch: 0,4 – 0,08 = 0,32 mol
Nồng độ của HCl còn lại trong dung dịch là:
CMHCl = (0,32 ×1000)/200 = 1,6 mol/l
Nồng độ của MnCl2 trong dung dịch là:
CMMnCl2 = (0,02 ×1000)/200 = 0,1 mol/l
Câu 32. Từ một tấn muối ăn có chứa 10,5% tạp chất, người ta điều chế được 1250 lít dung dịch HCl 37% (D = 1,19 g/ml) bằng cách cho lượng muối ăn trên tác dụng với axit sunfuric đậm đặc và đun nóng. Tính hiệu suất của quá trình điều chế trên.
Lượng NaCl nguyên chất:
1000 kg × 89,5% = 895 kg
Lượng HCl thu được theo lí thuyết:
2NaCl + H2SO4 → Na2SO4 + 2HCl
58,5 36,5 g
895 x = 558,42 kg
Lượng HCl thu được theo thực tế:
1250 lit × 1,19kg/lit × 37% = 550,375 kg
Hiệu suất của quá trình điều chế:
H% = 550,375/558,42 × 100% = 98,55%
Câu 33. Hoàn thành các phản ứng:
KClO3 → A+ B
A + MnO2 + H2SO4 → C + D + E + F
A → G + C
G + H2O → L + M
C + L → KClO3 + A + F
2KClO3 → 2KCl + 3O2
2KCl + MnO2 + 2H2SO4 → Cl2 + K2SO4 + MnSO4 + 2H2O
2KCl → 2K + Cl2
2K + 2H2O → 2KOH + H2
3Cl2 + 6KOH → KClO3 + 5KCl + 3H2O
Câu 34. Hòa tan 12 gam hỗn hợp hai muối cacbonat kim loại bằng dung dịch HCl dư ta thu được dung dịch A và 1,008 lít khí bay ra (đktc). Số gam muối khan thu được khi cô cạn dung dịch A là bao nhiêu?

Câu 35. Phản ứng nào sau đây được dùng để điều chế khí hidro clorua trong phòng thí nghiệm?
A. H2 + Cl2 → 2HCl
B. Cl2 + H2O ↔ HCl + HClO
C. NaCl(rắn) + H2SO4(đặc) → NaHSO4 + HCl
D. Cl2 + SO2 + 2H2O → 2HCl + H2SO4
Đáp án C
Câu 36. Sục khí clo qua dung dịch K2CO3 thấy có khí thoát ra đã xảy ra phản ứng:
A. Cl2 + H2O ↔ HCl + HClO ; 2HCl + K2CO3 → 2KCl + CO2 + H2O
B. Cl2 + K2CO3 → 2KCl + CO2 + H2O
C. 2HClO + K2CO3 → 2KCl + CO2 + H2O + O2
D. Cl2 + H2O ↔ HCl + HClO; 2HClO + K2CO3 → 2KClO + CO2 + H2O
Đáp án A
Câu 37. Phương trình nào sau đây được dùng để điều chế hidro bromua trong thực tế?
A. H2SO4 đặc + KBr → KHSO4 + HBr
B. HCl + KBr → KCl + HBr
C. PBr3 + 3H2O → H3PO3 + 3HBr
D. HNO3 + KBr → KNO3 + HB
Đáp án C
Câu 38. Những dãy chất nào trong các dãy sau được dùng để điều chế nước Ja – ven trong phòng thí nghiệm?
A. NaCl, MnO2, H2SO4 đặc
B. NaCl, MnO2, NaOH, H2SO4 đặc
C. H2O, KCl
D. Ca(OH)2, NaCl, Cl2
4NaCl + 4H2SO4đ + MnO2 → MnCl2 + 4NaHSO4 + Cl2↑ + 2H2O
Cl2 + 2NaOH → NaCl + NaClO + H2O
Đáp án B
Câu 39. Cho một halogen tác dụng với nhôm thì thu được muối trong đó khối lượng muối gấp 9,89 lần khối lượng Al đã phản ứng. Vậy halogen là:
A. Flo B. Clo C. Brom D. Iot
2Al + 3X2 → 2AlX3
Theo đề ra: (2 ×(27+3X))/2.27 = 9,89
→ X = 80 → X là Br
Đáp án C
Câu 40. Có 185,4 gam dung dịch axit clohidric 10%. Hòa tan thêm Vlít khí HCl ở điều kiện chuẩn để thu được dung dịch axit clohidric 16,57%. Vậy V (lít) có giá trị là:
A. 5,6 B. 6,72 C. 8,96 D. 11,2
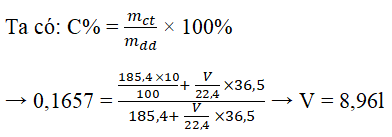
Đáp án C
Câu 41. Cho 4,05 gam một kim loại M chưa rõ hóa trị tác dụng với brom thu được 40,05 gam muối. M là:
A. Mg B. Al C. Fe D. Cu
Phương trình phản ứng.
M + n/2Br2 → MBrn
M M + 80n
4,05 40,05
→ M = 9n → M chỉ có thể là Al
Đáp án B
Câu 42. Cho 17,4 gam MnO2 tác dụng hết với HCl lấy dư. Toàn bộ khí clo sinh ra được hấp thụ hết vào 148,5 gam dung dịch NaOH 20% (ở nhiệt độ thường) tạo ra dung dịch A. Vậy dung dịch A có các chất và nồng độ % tương ứng như sau:
A. NaCl 10% ; NaClO 5%
B. NaCl 7,31%; NaClO 6,81%, NaOH 6%
C. NaCl 7,19%; NaClO 9,16%, NaOH 8,42%
D. NaCl 7,31%; NaClO 9,31%, HCl 5%
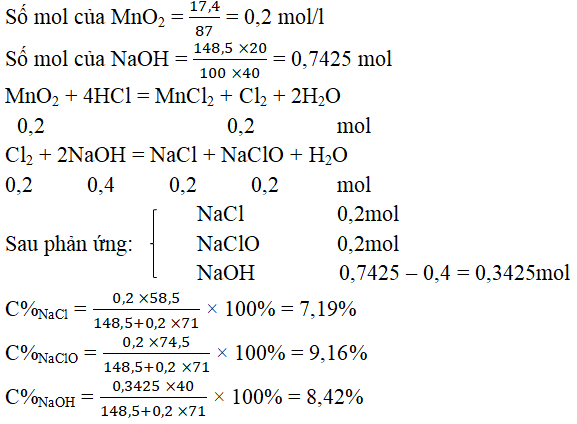
Đáp án C
Câu 43. Cho 19,05 gam hỗn hợp KF và KCl tác dụng hết với dung dịch H2SO4 đặc thu được 6,72 lít khí (đktc). Vậy % theo khối lượng của KF và KCl là:
A. 60,20% và 39,80% B. 60,89% và 39,11%
C. 39,11% và 60,89% D. 70% và 30%
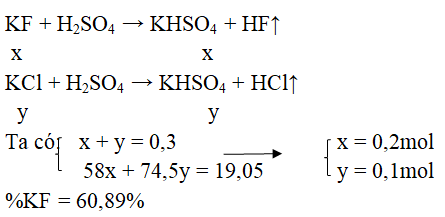
Đáp án B
Câu 44. Dẫn từ từ khí clo qua bình đựng KI có chứa sẵn hồ tinh bột. Hiện tượng quan sát được là:
A. Dung dịch hiện màu vàng
B. Dung dịch hiện màu xanh
C. Dung dịch có màu trắng
D. Có kết tủa màu vàng nhạt
Đáp án B
Câu 45. Cho 2,24 lít khí HCl ở đkc vào 100ml dung dịch NaOH 1,2M. Dung dịch sau phản ứng có môi trường:
A. Axit B. Bazơ C. Trung tính D. Lưỡng tính
Số mol các chất
nHCl = 0,1 mol; nNaOH = 0,12mol
NaOH + HCl → NaCl + H2O
nNaOHdư → môi trường bazơ → quỳ tím chuyển màu xanh
Đáp án B
Trên đây VnDoc đã giới thiệu tới các bạn lý thuyết Hóa học 10: Trắc nghiệm chương 5: Nhóm Halogen phần 1. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 10, Giải bài tập Hóa học lớp 10, Giải bài tập Vật Lí 10, Tài liệu học tập lớp 10 mà VnDoc tổng hợp và giới thiệu tới các bạn đọc.








