Hóa học 10 bài 22: Clo
Chuyên đề Hóa học lớp 10: Clo được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Lý thuyết: Clo
A/ Lý thuyết Hóa học 10 bài 22
I. Tính chất vật lý
- Là chất khí, màu vàng, mùi xốc, độc và nặng hơn không khí.
- Cl2 có một liên kết cộng hóa trị, dễ dàng tham gia phản ứng,là một chất oxi hóa mạnh.
- Tham gia các phản ứng Clo là chất oxi hoá, tuy nhiên clo cũng có khả năng đóng vai trò là chất khử.
II. Tính chất hoá học
1. Tác dụng với kim loại
Đa số kim loại và có to để khơi màu phản ứng tạo muối clorua (có hoá trị cao nhất)
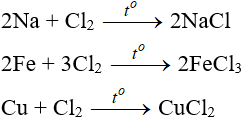
2. Tác dụng với phim kim
(cần có nhiệt độ hoặc có ánh sáng)
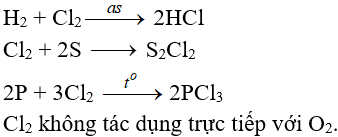
3. Tác dụng với nước và dung dịch kiềm
Cl2 tham gia phản ứng với vai trò vừa là chất ôxi hóa, vừa là chất khử.
a. Tác dụng với nuớc
Khi hoà tan vào nước, một phần Clo tác dụng (Thuận nghịch)
Cl20 + H2O → HCl + HClO (Axit hipoclorơ)
Axit hipoclorơ có tính oxy hoá mạnh, nó phá hửy các màu vì thế nước clo hay clo ẩm có tính tẩy màu do.
b. Tác dụng với dung dịch bazơ
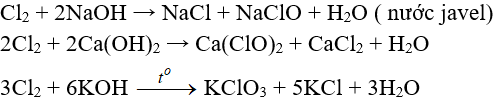
4. Tác dụng với muối của các halogen khác
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2FeCl2 → 2FeCl3
3Cl2 + 6FeSO4 → 2Fe2(SO4)3 + 2FeCl3
Cl2 + 2KI → 2KCl + I2
5. Tác dụng với chất khử khác
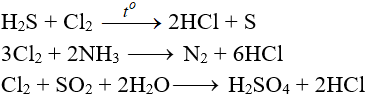
6. Phản ứng thế, phản ứng cộng, phản ứng phân huỷ với một số hợp chất hữu cơ
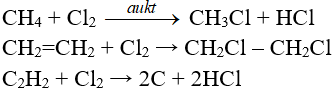
III. Ứng dụng
Clo có vai trò rất quan trọng trong công nghiệp chất:
- Dùng để sát trùng nước khi xử lí nước thải.
- Tẩy trắng sợi, giấy, vải.
- Là nguyên liệu để sản xuất nhiều hợp chất vô cơ và hữu cơ. Sản phẩm hữu cơ chứa clo có ý nghĩa to lớn trong công nghiêp.
IV. Trạng thái tự nhiên
- Trong tự nhiên Clo có 2 đồng vị 3517Cl (75%) và 3717Cl (25%) ⇒ M−Cl = 35,5.
- Do hoạt động hóa học mạnh nên clo chỉ tồn tại trong tự nhiên ở dạng hợp chất, chủ yếu là muối clorua.
- Hợp chất quan trọng nhất của clo là natri clorua.
V. Điều chế
Nguyên tắc là khử các hợp chất Cl- tạo Cl0
a. Trong phòng thí nghiệm
Cho HCl đậm đặc tác dụng với các chất ôxi hóa mạnh
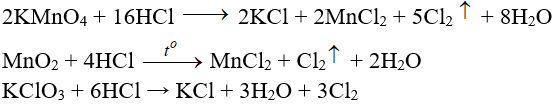
b. Trong công nghiệp
Dùng phương pháp điện phân
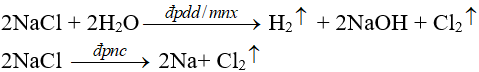
(bổ sung thêm kiến thức về điện phân)
(nếu quá trình điện phân không có màng ngăn thì sản phẩm thu được là dung dịch nước javel)
Ngoài ra còn có thể từ HCl và O2 có xúc tác là CuCl2 ở 400oC.
![]()
B/ Trắc nghiệm Hóa học 10 bài 22
Câu 1: Trong các halogen, clo là nguyên tố
A. Có độ âm điện lớn nhất.
B. Có tính phi kim mạnh nhất.
C. Tồn tại trong vỏ Trái Đất (dưới dạng các hợp chất) với trữ lượng lớn nhất.
D. Có số oxi hóa –1 trong mọi hợp chất.
Câu 2: Ứng dụng không phải của clo là:
A. Sản xuất tẩy trắng, sát trùng và hóa chất vô cơ
B. Diệt trùng, tẩy trắng
C. Sản xuất các hóa chất hữu cơ
D. Sản xuất nhựa teflon làm nhựa chống dính ở xoong chảo
Câu 3: Phản ứng giữa Cl2 và H2 có thể xảy ra ở điều kiện:
A. Có khí HCl làm xúc tác
B. Ánh sáng khuếch tán
C. Nhiệt độ thường và bóng tối
D. Nhiệt độ tuyệt đối 273K
Câu 4: Cho clo vào nước, thu được nước clo. Biết clo tác dụng không hoàn toàn với nước. Nước clo là hỗn hợp gồm các chất
A. HCl, HClO
B. HClO, Cl2, H2O
C. H2O, HCl, HClO
D. H2O, HCl, HClO, Cl2
Câu 5: Trong phòng thí nghiệm, người ta thường điều chế clo bằng cách
A. Điện phân nóng chảy NaCl.
B. Cho dung dịch HCl đặc tác dụng với MnO2, đun nóng.
C. Điện phân dung dịch NaCl có màng ngăn.
D. Cho F2 đẩy Cl2 ra khỏi dung dịch NaCl.
Câu 6: Cho kim loại M tác dụng với Cl2 được muối X; cho kim lọa M tác dụng với dung dịch HCl được muối Y. Nếu cho dung dịch muối Y tác dụng với Cl2 cũng thu được muối X. Kim loại M có thể là
A. Mg
B. Zn
C. Al
D. Fe
Câu 7: Cho các mệnh đề sau:
- Khí hidro clorua khô không tác dụng được với CaCO3 để giải phóng khí CO2
- Clo có thể tác dụng trực tiếp với oxi tạo ra các oxit axit
- Flo là phi kim mạnh nhất, nó có thể tác dụng trực tiếp với tất cả các nguyên tố khác
- Clorua vôi có tính oxi hóa mạnh
Số mệnh đề phát biểu đúng là
A. 2 B. 1 C. 4 D. 3
Câu 8: Cho các hợp chất sau: HCl, HClO, HClO3, NaClO, NaClO4.
Số oxi hóa của clo trong các hợp chất trên lần lượt là dãy nào sau đây?
A. -1; +1; +3; +1; +5
B. -1; +1; +7; + 1; +5
C. -1; -1; +5; +1; +7
D. -1; +1; +5; +1; +7
Câu 9: Trong tự nhiên, clo tồn tại dưới dạng
A. Muối NaCl có trong nước biển và muối mỏ
B. Khoáng vật sinvinit (KCl.NaCl)
C. Đơn chất Cl2
D. Khoáng vật cacnalit (KCl.MgCl.6H2O)
Câu 10: Chất dung để làm khô khí Cl2 ẩm là
A. Dung dịch H2SO4 đậm đặc.
B. Na2SO3 khan.
C. CaO.
D. Dung dịch NaOH đặc.
Câu 11: Đốt cháy 29,25 gam kẽm trong khí clo thu được 48,96 gam kẽm clorua (ZnCl2). Hiệu suất của phản ứng trên là
A. 80%
B. 75%
C. 85%
D. 90%
Câu 12: Đốt cháy sắt trong khí clo, người ta thu được 32,5 gam muối. Thể tích khí clo (đktc) đã tham gia phản ứng là
A. 6,72 lít.
B. 13,44 lít.
C. 4,48 lít.
D. 2,24 lít.
Câu 13: Nước clo có tính tẩy màu và sát trùng vì có đặc điểm nào sau đây?
A. Tạo ra ion Cl+ có tính oxi hóa mạnh
B. Tạo ra axit HClO có tính oxi hóa mạnh
C. Clo tác dụng với nước tạo ra HCl có tính tẩy màu
D. Clo có tính oxi hóa mạnh
Câu 14: Phương pháp để thu khí clo trong phòng thí nghiệm là
A. Phương pháp đẩy không khí
B. Thu qua dung dịch NaCl bão hòa
C. Thu qua nước nóng
D. Cả ba phương pháp trên
Câu 15: Phát biểu nào sau đây là không đúng khi nói về số oxi hóa của clo?
A. Clo có số oxi hóa đặc trưng là -1
B. Clo chỉ có một số oxi hóa là -1
C. Clo có thể có các oxi hóa sau: -1; +1; +3; +5; +7
D. Do clo có phân lớp 3d còn trống nên clo có nhiều số oxi hóa
Câu 16: Đốt cháy 11,9 gam hỗn hợp gồm Zn, Al trong khí Cl2 dư. Sauk hi các phản ứng xảy ra hoàn toàn, thu được 40,3 gam hỗn hợp muối. Thể tích khí Cl2 (đktc) đã phản ứng là
A. 17,92 lít.
B. 6,72 lít.
C. 8,96 lít.
D. 11,20 lít.
Câu 17: Nguyên tố nào sau đây không phản ứng trực tiếp với clo?
A. Cacbon
B. Magie
C. Kẽm
D. Lưu huỳnh
Câu 18: Nguyên tố Cl ở ô thứ 17 trong bảng tuần hoàn, cấu hình electron của ion Cl- là
A. 1s22s22p63s23p4.
B. 1s22s22p63s23p2.
C. 1s22s22p63s23p6.
D. 1s22s22p63s23p5.
Câu 19: Hiện tượng sẽ quan sát được khi cho nước clo thêm dần vào dung dịch KI có chứa sẵn hồ tinh bột?
A. Có hơi màu tím bay lên
B. Dung dịch chuyển sang màu vàng
C. Dung dịch có màu xanh đặc trưng
D. Không có hiện tượng gì
Câu 20: Khi hạ nhiệt độ xuống giá trị -100,98∘C thì khí clo sẽ hóa rắn. Ở trạng thái rắn, clo thuộc loại tinh thể nào?
A. Tinh thể ion
B. Tinh thể nguyên tử
C. Tinh thể phân tử
D. Không xác định được
Câu 21: Phản ứng nào sau đây thể hiện clo vừa có tính khử vừa có tính oxi hóa?
A. 3Cl2 + 2NH3 → 6HCl + N2
B. Cl2 + SO2 + 2H2O → 2HCl + H2SO4
C. Cl2 + 2NaOH → NaCl + NaClO + H2O
D. 3Cl2 + 2Fe → 2FeCl3
Câu 22: Cho 7,84 lít hỗn hợp khí X (đktc) gồm Cl2 và O2 phản ứng vừa đủ với 11,1 gam hỗn hợp Y gồm Mg và Al, thu được 30,1 gam hỗn hợp Z. Phần trăm khối lượng của Al trong Y là
A. 75,68%.
B. 24,32%.
C. 51,35%.
D. 48,65%.
Câu 23: Sục Cl2 vào nước, thu được nước clo màu vàng nhạt. Trong nước clo có chứa các chất là
A. Cl2, H2O.
B. HCl, HClO.
C. HCl, HClO, H2O.
D. Cl2, HCl, HClO, H2O.
Câu 24: Hòa tan khí Cl2 vào dung dịch KOH đặc, nóng, dư. Dung dịch thu được có các chất thuộc dãy nào dưới đây?
A. KCl, KClO3, Cl2.
B. KCl, KClO3, KOH, H2O.
C. KCl, KClO, KOH, H2O.
D. KCl, KClO3.
Câu 25: Cho 10,8 gam kim loại M hóa trị III tác dụng với khí clo dư thì thu được 53,4 gam muối. Kim loại M là
A. Al B. Cr C. Fe D.Ni
Đáp án
| 1C | 2D | 3B | 4D | 5B | 6C | 7A | 8C | 9A | 10A |
| 11A | 12A | 13B | 14D | 15B | 16C | 17A | 18C | 19C | 20C |
| 21C | 22B | 23D | 24B | 25C |
------------------------------------------
Trong phần chuyên đề trên đây chúng ta có thể hiểu biết thêm về Clo gồm các phản ứng hóa học, cấu hình nguyên tử, điều chế clo trong phòng thí nghiệm và thực tế...
Như vậy VnDoc đã giới thiệu các bạn tài liệu Lý thuyết Hóa học lớp 10 bài 22: Clo. Mời các bạn tham khảo thêm tài liệu: Trắc nghiệm Sinh học 10, Giải bài tập Sinh học lớp 10, Giải Vở BT Sinh Học 10, Giải bài tập Sinh học 10 ngắn nhất, Tài liệu học tập lớp 10.
Để tiện trao đổi, chia sẻ kinh nghiệm về giảng dạy và học tập các môn học lớp 10, VnDoc mời các thầy cô giáo, các bậc phụ huynh và các bạn học sinh truy cập nhóm riêng dành cho lớp 10 sau: Nhóm Tài liệu học tập lớp 10. Rất mong nhận được sự ủng hộ của các thầy cô và các bạn.








