Hóa học 10 bài 7: Bảng tuần hoàn các nguyên tố hóa học
Chuyên đề Hóa học lớp 10: Bảng tuần hoàn các nguyên tố hóa học được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Lý thuyết: Bảng tuần hoàn các nguyên tố hóa học
A/ Lý thuyết Hóa học 10 bài 7
I. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
- Các nguyên tố được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
- Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng. (chu kì)
- Các nguyên tố có cùng số e hóa trị trong nguyên tử được xếp thành một cột. (nhóm)
II. Cấu tạo bảng tuần hoàn
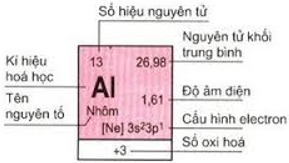
1. Ô nguyên tố
Số thứ tự của ô nguyên tố đúng bằng số hiệu nguyên tử của nguyên tố đó (= số e = số p = số đơn vị điện tích hạt nhân).
2. Chu kì
Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân tăng dần.
Số thứ tự của chu kì trùng với số lớp electron của nguyên tử các nguyên tố trong chu kì đó.
* Chu kì nhỏ: gồm chu kì 1, 2, 3.
* Chu kì lớn: gồm chu kì 4, 5, 6, 7.
Ví dụ: 12Mg: 1s2/2s22p6/3s2.
→ Mg thuộc chu kì 3 vì có 3 lớp electron.
3. Nhóm nguyên tố
- Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được xếp thành một cột.
- Có 2 loại nhóm nguyên tố là nhóm A và nhóm B:
+ Nhóm A: bao gồm các nguyên tố s và p.
Số thứ tự nhóm A = tổng số e lớp ngoài cùng.
+ Nhóm B: bao gồm các nguyên tố d và f có cấu hình e nguyên tử tận cùng dạng (n – 1)dxnsy:
* Nếu (x + y) = 3 → 7 thì nguyên tố thuộc nhóm (x + y)B.
* Nếu (x + y) = 8 → 10 thì nguyên tố thuộc nhóm VIIIB.
* Nếu (x + y) > 10 thì nguyên tố thuộc nhóm (x + y – 10)B.
- Khối các nguyên tố s, p, d, f
- Khối các nguyên tố s: gồm các nguyên tố nhóm IA và IIA
Là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp s.
Ví dụ: 11Na: 1s22s22p63s1
- Khối các nguyên tố p: gồm các nguyên tố thuộc các nhóm từ IIIA đến VIIIA (trừ He).
Là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp p.
Ví dụ: 13Al: 1s22s22p63s23p1
- Khối các nguyên tố d: gồm các nguyên tố thuộc nhóm B.
Là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp d.
Ví dụ: 26Fe: 1s22s22p63s23p63d64s2
- Khối các nguyên tố f: gồm các nguyên tố thuộc họ Lantan và họ Actini.
Là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp f.
Ví dụ: 58Ce: 1s22s22p63s23p63d104s24p64f25s25p66s2
B/ Trắc nghiệm Hóa học 10 bài 7
Câu 1: Nhóm A bao gồm các nguyên tố
A. Nguyên tố s
B. Nguyên tố p
C. Nguyên tố d và nguyên tố f.
D. Nguyên tố s và nguyên tố p
Câu 2: Trong bảng hệ thống tuần hoàn các nguyên tố, số chu kì nhỏ và chu kì lớn là
A. 3 và 3
B. 4 và 3
C. 3 và 4
D. 4 và 4
Câu 3: Nguyên tố M có số hiệu nguyên tử là 29. M thuộc nhóm nào của bảng tuần hoàn?
A. IIA
B. IIB
C. IA
D. IB
Câu 4: Nguyên tố R có tổng số hạt mang điện và không mang điện là 34. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 10 hạt. Kí hiệu và vị trí ucar R trong bảng tuần hoàn là
A. Ne, chu kì 2, nhóm VIIIA
B. Na, chu kì 3, nhóm IA
C. Mg, chu kì 3, nhóm IIA
D. F, chu kì 2, nhó VIIA
Câu 5: Các nguyên tố X, Y, Z có số hiệu nguyên tử tương ứng là 4, 8, 16, 25. Kết luận nào dưới đây về vị trí nguyên tố trong bảng tuần hoàn là đúng?
|
|
Số hiệu nguyên tử |
Chu kì |
Nhóm |
|
A |
4 |
2 |
IV |
|
B |
8 |
2 |
IV |
|
C |
16 |
3 |
VI |
|
D |
25 |
4 |
V |
Câu 6: X là nguyên tố phi kim có hóa trị cao nhất với oxi bằng hóa trị với hidro. Số nguyên tố thỏa mãn điều kiện trên là:
A. 2
B. 4
C. 3
D. 1
Câu 7: R, T, X, Y, Z lần lượt là năm nguyên tố liên tiếp trong bảng tuần hoàn, có tổng số điện tích hạt nhân là 90+. Kết luận nào sau đây đúng?
A. Năm nguyên tố này thuộc cùng một chu kì.
B. Nguyên tử của nguyên tố Z có bán kính lớn nhất trong số các nguyên tử của năm nguyên tố trên.
C. X là phi kim.
D. R có 3 lớp electron.
Câu 8: Hai nguyên tố X và Y la hai nguyên tố ở hai nhóm A kế tiếp nhau có tổng điện tích dương bằng 23 và cùng thuộc một chu kì. X và Y là
A. N và S
B. Si và F
C. O và P
D. Na và Mg
Câu 9: Nguyên tố M thuộc chu kì 3, nhóm IVA của bảng tuần hoàn. Số hiệu nguyên tử của nguyên tố M là
A. 14
B. 16
C. 33
D. 35
Câu 10: Cho các nguyên tố: Mg (12); Al (13); Si (14); P (15); Ca (20). Các nguyên tố thuộc cùng một chu kì là:
A. Mg, Al, Si, P
B. P, Al, Si, Ca
C. Mg, Al, Ca
D. Mg, Al, Si, Ca
Câu 11: Cho hai nguyên tố L và M có cùng cấu hình electron lớp ngoài cùng là ns2. Phát biểu nào sau đây về M và L luôn đúng?
A. L và M đều là những nguyên tố kim loại.
B. L và M thuộc cùng một nhóm trong bảng tuần hoàn.
C. L và M đều là những nguyên tố s.
D. L và M có 2 electron ở ngoài cùng.
Câu 12: Hai nguyên tố X và Y cùng thuộc một chu kì và ở hai nhóm A kế tiếp nhau có tổng số proton trong hai hạt nhân nguyên tử là 25. X và Y thuộc chu kì và nhóm nào sau đây trong bảng tuần hoàn?
A. Chu kì 3 và các nhóm IIA, IIIA
B. Chu kì 2 và các nhóm IIA, IIIA
C. Chu kì 3 và các nhóm IA, IIA
D. Chu kì 2 và các nhóm IA, IIA
Câu 13: Cho các nguyên tố 8X, 11Y, 20Z và 26T. Số electron hóa trị của nguyên tử các nguyên tố tang dần theo thứ tự:
A. X < Y < Z < T.
B. T < Z < X < Y.
C. Y < Z < X < T.
D. Y < X < Z < T.
Câu 14: Nguyên tố thuộc nhóm và chu kì nào trong bảng tuần hoàn thì có cấu hình electron hóa trị là 4s1?
A. Chu kì 1 nhóm IVA
B. Chu kì 4, nhóm IA
C. Chu kì 1, nhóm IVB
D. Chu kì 4, nhóm IB
Câu 15: X và Y là hai nguyên tố kế tiếp nhau trong cùng một nhóm A của bảng tuần hoàn. Biết rằng tổng số electron trong nguyên tử X và Y là 30, số electron của X nhỏ hơn số electron của Y. Phát biểu nào sau đây là sai?
A. X thuộc chu kì nhỏ và Y thuộc chu kì lớn của bảng tuần hoàn.
B. X và Y đều là những kim loại.
C. X và Y đều đứng đầu mỗi chu kì trong bảng tuần hoàn.
D. X và Y đều có cùng số lớp electron bão hòa.
Câu 16: Xét các nguyên tố mà nguyên tử có lớp electron ngoài cùng là lớp M. Số nguyên tố mà nguyên tử của nó có 1 electron độc thân là
A. 3
B. 4
C. 1
D. 2
Câu 17: X và Y là hai nguyên tố thuộc nhóm A và thuộc cùng một chu kì của bảng tuần hoàn. X là một kim loại và Y là một phi kim. Tổng số electron hóa trị của X và Y là 8. Phát biểu nào sau đây là đúng?
A. Nếu X là Al thì Y có thể là Cl.
B. Nếu Y là Se thì X có thể là Zn.
C. X và Y có thể tạo thành hợp chất có công thức hóa học XY.
D. X và Y có thể là những nguyên tố thuộc nhóm IVA.
Câu 18: Số thứ tự ô nguyên tố trong bảng hệ thống tuần hoàn bằng
A. Số hiệu nguyên tử
B. Số khối
C. Số nơtron
D. Số electron hóa trị
Câu 19: Hợp chất A được tạo thành từ cation X+ và anion Y2−. Mỗi ion đều do 5 nguyên tử của hai nguyên tố tạo nên. Tổng số proton trong X+ là 11, tổng số electron trong Y2− là 50. Biết rằng hai nguyên tố trong Y2− đều thuộc cùng một nhóm A và thuộc hai chu kì liên tiếp. Phân tử khối của A là
A. 96
B. 78
C. 114
D. 132
Câu 20: X và Y là hai nguyên tố cùng thuộc một phân nhóm chính thuộc hai chu kì kế tiếp nhau trong bảng tuần hoàn. Tổng số proton trong hạt nhân của hai nguyên tố bằng 58. Số hiệu nguyên tử của X và Y lần lượt là
A. 25, 33
B. 19, 39
C. 20, 38
D. 24, 34
Câu 21: X và Y là hai nguyên tố thuộc hai nhóm A kế tiếp nhau trong bảng tuần hoàn, ở trạng thái đơn chất X và Y phản ứng được với nhau. Tổng số proton trong hạt nhân nguyên tử của X và Y là 23. Biết rằng X đứng sau Y trong bảng tuần hoàn. X là
A. O
B. S
C. Mg
D. P
Câu 22: Vị trí của nguyên tử nguyên tố X có Z= 27 trong bảng tuần hoàn là:
A. Chu kì 4, nhóm VIIB
B. Chu kì 4, nhóm VIIIB
C. Chu kì 4,nhóm IIA
D. Chu kì 3, nhóm IIB
Câu 23: Nguyên tắc sắp xếp các nguyên tố vào bảng tuần hoàn:
(a) Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử ;
(b) Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp vào cùng một hàng ;
(c) Các nguyên tố có cùng số electron hóa trị được xếp vào một cột ;
(d) Số thứ tự của ô nguyên tố bằng số hiệu của nguyên tố đó
Số nguyên tắc đúng là:
A. 1
B. 2
C. 3
D. 4
Câu 24: Electron cuối cùng của nguyên tố M được điền vào phân lớp 3d3. Vị trí của M trong bảng tuần hoàn là:
A. Chu kì 3, nhóm IIIB
B. Chu kì 3, nhóm VB
C. Chu kì 4, nhóm IIB
D. Chu kì 4, nhóm VB
Câu 25: Mệnh đề nào sau đây không đúng?
A. Trong chu kì, các nguyên tố được sắp xếp theo chiều điện tích hạt nhân tăng dần.
B. Các nguyên tố trong cùng chu kì có số lớp electron bằng nhau.
C. Nguyên tử của các nguyên tố trong cùng phân nhóm bao giờ cũng có cùng số electron hóa trị.
D. Trong chu kì, các nguyên tố được sắp xếp theo chiều khối lượng nguyên tử tăng dần.
Đáp án
| 1D | 2C | 3D | 4B | 5C | 6A | 7D | 8D | 9A | 10A |
| 11D | 12A | 13C | 14B | 15D | 16A | 17C | 18A | 19D | 20C |
| 21D | 22B | 23C | 24D | 25D |
--------------------------------------------
Trong phần chuyên đề trên đây chúng ta có thể hiểu biết thêm về Bảng tuần hoàn các nguyên tố hóa học gồm các nguyên tắc sắp xếp nguyên tố hóa học trong bảng tuần hoàn, các cấu tạo của ô trong bảng tuần hoàn
Như vậy VnDoc đã giới thiệu các bạn tài liệu Lý thuyết Hóa học lớp 10 bài 7: Bảng tuần hoàn các nguyên tố hóa học. Mời các bạn tham khảo thêm tài liệu: Trắc nghiệm Sinh học 10, Giải bài tập Sinh học lớp 10, Giải Vở BT Sinh Học 10, Giải bài tập Sinh học 10 ngắn nhất, Tài liệu học tập lớp 10.
Để tiện trao đổi, chia sẻ kinh nghiệm về giảng dạy và học tập các môn học lớp 10, VnDoc mời các thầy cô giáo, các bậc phụ huynh và các bạn học sinh truy cập nhóm riêng dành cho lớp 10 sau: Nhóm Tài liệu học tập lớp 10. Rất mong nhận được sự ủng hộ của các thầy cô và các bạn.








