Trắc nghiệm chương 5: Nhóm Halogen phần 2
Chuyên đề Hóa học lớp 10: Trắc nghiệm chương 5: Nhóm Halogen phần 2 được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Bài tập trắc nghiệm chương 5
Bài 1: Cấu hình electron lớp ngoài cùng của các nguyên tử Halogen là:
A. ns2 np4. B. ns2 np5 C. ns2 np6 D. (n – 1)d10 ns2 np5.
Đáp án B.
Nguyên tố halogen thuộc nhóm VIIA trong bảng tuần hoàn.
Bài 2: Cho dãy dung dịch axit sau HF, HCl, HBr, HI. Dung dịch có tính axit mạnh nhất và tính khử mạnh nhất là:
A. HF B. HCl C. HBr D. HI
Đáp án D.
Bài 3: Khi sục chất khí nào sau đây vào dung dịch KI có hồ tinh bột thì sau phản ứng dung dịch có màu xanh:
A. Cl2 B. O3 C. O2 D. Cl2, O3
Đáp án D.
Phản ứng sinh ra I2 làm xanh hồ tinh bột
Cl2 + KI → I2 + KCl
O3 + 2KI + H2O → 2KOH + I2 + O2
Bài 4: Tính oxi hóa của Br2:
A. mạnh hơn Flo nhưng yếu hơn Clo.
B. mạnh hơn Clo nhưng yếu hơn Iot.
C. mạnh hơn Iot nhưng yếu hơn Clo.
D. mạnh hơn Flo nhưng yếu hơn Iot.
Đáp án C.
Tính oxi hóa giảm dần theo thứ tự F → Cl → Br → I
Bài 5: Cho một luồng khí clo dư tác dụng với 9,2 gam kim loại sinh ra 23,4 gam muối kim loại M hoá trị I. Muối kim loại hoá trị I là muối nào sau đây?
A. NaCl. B. KCl. C. LiCl. D. Kết quả khác
Đáp án A
2M + Cl2 → 2MCl
Ta có 
⇒ M = 23 (Na)
Vậy muối là NaCl.
Bài 6: Trong phản ứng hóa học sau, Brom đóng vai trò là :
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
A. Chất khử.
B.Vừa là chất oxi hóa vừa là chất khử.
C.Chất oxi hóa.
D.Không là chất oxi hóa không là chất khử.
Đáp án C
Bài 7: Chất khí có thể làm mất màu dung dịch nước Brom là:
A. SO2. B. CO2. C. O2. D. HCl.
Đáp án A.
Phản ứng xảy ra: SO2 + Br2 + 2H2O → H2SO4 + 2HBr
Bài 8: Đổ dd chứa 1 g HBr vào dd chứa 1 g NaOH. Nhúng giấy quì tím vào dung dịch thu được thì giấy quì tím chuyển sang màu:
A. Màu đỏ. B. Màu xanh. C. Không màu. D. Màu tím.
Đáp án B
HBr + NaOH → NaBr + H2O
⇒ NaOH dư, HBr phản ứng hết ⇒ dung dịch làm quỳ chuyển sang màu xanh.
Bài 9: Trong hợp chất, nguyên tố Flo thể hiện số oxi hóa là:
A. 0 B. +1 C. -1 D. +3
Đáp án C
Bài 10: Cho dung dịch AgNO3 dư vào 100ml dung dịch chứa hỗn hợp NaF 1M và NaBr 0,5M. Lượng kết tủa thu được là:
A. 22,1g. B. 10g. C. 9,4g D. 8,2g.
Đáp án C
nNaBr = 0,5.0,1 = 0,05 (mol)
AgNO3 không phản ứng với NaF.
AgNO3 + NaBr → AgBr↓ + NaNO3
0,05 0,05
m↓ = 0,05 (108 + 80) = 9,4 (g)
Bài 11: Cho lượng dư dung dịch AgNO3 vào dung dịch hỗn hợp gồm 0,1 mol NaF và 0,1 mol NaCl. Khối lượng kết tủa tạo thành là
A. 14,35 g. B. 10,8 g. C. 21,6 g. D. 27,05 g.
Đáp án A.
NaF không phản ứng với AgNO3.
AgNO3 + NaCl → AgCl↓ + NaNO3
0,1 mol → 0,1 mol
m↓ = 0,1.(108+35,5) = 14,35 (g)
Bài 12: Phát biểu nào sau đây không chính xác:
A. Halogen là những phi kim điển hình, chúng là những chất oxi hóa.
B. Trong hợp chất các halogen đều có thể có số oxi hóa: -1, +1, +3, +5, +7.
C. Khả năng oxi hóa của halogen giảm dần từ flo đến iot
D. Các halogen khá giống nhau về tính chất hóa học.
Đáp án B.
Flo chỉ có số oxi hóa là -1.
Bài 13: Sắp xếp theo chiều tăng tính oxi hóa của các nguyên tử là:
A. I, Cl, Br, F
B. Cl, I, F, Br.
C. I, Br, Cl, F
D. I, Cl, F, Br
Đáp án C.
Bài 14: Cho 0,3 gam một kim loại hóa trị II phản ứng hết với dung dịch HCl dư, thu được 0,28 lít H2 (đktc). Kim loại đó là?
A. Ba B. Ca C. Mg. D. Sr.
Đáp án C
nH2 = 0,28/22,4 = 0,0125 (mol)
M + 2HCl → MCl2 + H2
0,0125 0,0125 (mol)
MM = 0,3/0,0125 = 24 (Mg)
Bài 15: Cấu hình electron lớp ngoài cùng của các ion Halogenua (X-) là:
A. ns2 np4.
B. ns2 np5
C. ns2 np6
D. (n – 1)d10 ns2 np5.
Đáp án C.
X + 1e → X-
ns2 np5 ns2 np6
Bài 16: Trong nước clo có chứa các chất:
A. HCl, HClO B. HCl, HClO, Cl2, H2O C. HCl, Cl2 D. Cl2
Đáp án B
Cl2 + H2O ⇔ HCl + HClO
Bài 17: Hòa tan khí Cl2 vào dung dịch KOH đặc, nóng, dư thu được dung dịch chứa các chất thuộc dãy nào sau đây?
A. KCl, KClO3, Cl2 B. KCl, KClO, KOH
C. KCl, KClO3, KOH D. KCl, KClO3
Đáp án C.
Cl2 + KOH to→ KCl + KClO3 + H2O
Bài 18: Cho m gam hỗn hợp Zn, Fe tác dụng với vừa đủ với 73 g dd HCl 10%. Cô cạn dd thu được 13,15 g muối. Giá trị m là:
A. 7,05 g B. 5,3 g C. 4,3 g D. 6,05 g
Đáp án D
→ mHCl = 7,3 (g), nHCl = 0,2 (mol)
mmuối = mKL + mgốc axit = m+ 0,2.35,5 = 13,15
⇒ m = 6,05 (g)
Bài 19: Cho 15 gam hỗn hợp bột kim loại Zn và Cu vào dung dịch HCl dư, sau khi phản ứng xảy ra hoàn toàn thu được 4,48 lít khí H2 (đktc) và m gam chất rắn không tan. Giá trị của m là:
A. 6,4. B. 8,5. C. 2,2. D. 2,0
Đáp án D.
Chất rắn không tan là Cu.
nH2= 0,2 (mol)
Zn + 2HCl → ZnCl2 + H2
0,2 ← 0,2 (mol)
mZn = 0,2.65 = 13 (g) ⇒ mCu = 15 – 13 = 2 (g)
Bài 20: Để điều chế clo, người ta có thể làm như sau:
A. Điện phân muối NaCl nóng chảy hoặc dung dịch NaCl bão hòa có màng ngăn.
B. Cho KMnO4 hoặc MnO2 tác dụng với dung dịch HCl đặc.
C. Cho KClO3 tác dụng với dung dịch HCl đặc.
D. A hoặc B hoặc C.
Đáp án D.
MnO2+4HCl → MnCl2+2H2O+Cl2
2KMnO4+16HCl → 2KCl+2MnCl2+8H2O+5Cl2
KClO3+6HCl → KCl+3H2O+3Cl2
2NaCl+2H2O đpdd→ Cl2 + 2NaOH+2H2
Bài 21: Có 4 bình mất nhãn đựng các dd :NaCl, NaNO3, BaCl2, Ba(NO3)2. Để phân biệt các dd trên, ta lần lượt dùng chất :
A. quì tím, dd AgNO3
B. dd Na2CO3, dd H2SO4
C. dd AgNO3, dd H2SO4
D. dd Na2CO3, dd HNO3
Đáp án C
| NaCl | NaNO3 | BaCl2 | Ba(NO3)2 | |
| Dd AgNO3 | ↓ trắng | - | ↓ trắng | - |
| dd H2SO4 | - | - | ↓ trắng | ↓ trắng |
PTHH: NaCl + AgNO3 → NaNO3 + AgCl
BaCl2 + 2AgNO3 → Ba(NO3)2 + 2AgCl
BaCl2 + H2SO4 → BaSO4 + 2HCl
Ba(NO3)2 + H2SO4 → BaSO4 + 2HNO3
Bài 22: Cho 17,4 gam MnO2 tác dụng với dd HCl đặc, dư và đun nóng. Thể tích khí thoát ra (đktc) là: (Mn = 55)
A. 4,48 lít. B. 2,24 lít. C. 3,36 lít. D. 6,72 lít.
Đáp án A.
mMnO2 = 17,4/(55+32) = 0,2 mol
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
0,2 0,2 (mol)
VCl2 = 0,2 . 22,4 = 4,48(l)
Bài 23: Hòa tan khí Cl2 vào dung dịch NaOH loãng, dư ở nhiệt độ phòng thu được dung dịch chứa các chất
A. NaCl, NaClO3, Cl2
B. NaCl, NaClO, NaOH
C. NaCl, NaClO3, NaOH
D. NaCl, NaClO3
Đáp án B.
Cl2 + 2NaOH → NaCl + NaClO + H2O
Dung dịch còn chứa NaOH dư.
Bài 24: Kim loại tác dụng được với axit HCl loãng và khí clo cho cùng một loại muối clorua kim loại là:
A. Fe. B. Zn. C. Cu. D. Ag.
Đáp án B.
Cu, Ag không phản ứng với HCl.
Fe + 2HCl → FeCl2 + H2
2Fe + 3Cl2 → 2FeCl3
Bài 25: Cho 10,5g hỗn hợp bột Mg, Fe tác dụng với dung dịch HCl dư thấy có 0,4g khí H2 bay ra. Khối lượng muối thu được:
A. 17,6g B. 25,1g C. 24,7g D. 17,8g
Đáp án C
nHCl = 2nH2 = 2. 0,4/2 = 0,4 mol
mmuối = mKL + mgốc axit = 10,5 + 0,4.35,5 = 24,7 (g)
Bài 26: Cho 4,45 gam hỗn hợp bột Zn, Mg tác dụng với dung dịch HCl dư thấy có 2,24 lít khí H2 bay ra (đktc). Khối lượng Zn trong hỗn hợp là:
A. 3,25 B. 4 C. 1,2. D. 1,625.
Đáp án A
Gọi nZn = a , nMg = b (mol)
Zn + 2HCl → ZnCl2 + H2
a → a (mol)
Mg + 2HCl → MgCl2 + H2
b b (mol)
Ta có: 65a + 24b = 4,45
a + b = 0,1
Giải ra ta có a = b = 0,05
mZn = 0,05.65 = 3,25 (g)
Bài 27: Trong muối NaCl có lẫn NaBr và NaI. Để loại hai muối này ra khỏi NaCl người ta có thể
A. nung nóng hỗn hợp.
B. cho hỗn hợp tác dụng với dung dịch HCl đặc.
C. cho hỗn hợp tác dụng với Cl2 sau đó đun nóng.
D. cả A, B và C.
Đáp án C.
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2NaI → 2NaCl + I2
Bài 28: Để phân biệt 5 dd riêng biệt sau: NaCl, NaBr, NaI, NaOH, HCl. Ta có thể dùng nhóm thuốc thử nào sau đây:
A. khí Clo, dd AgNO3 B. quì tím, dung dịch H2SO4
C. quì tím, dd AgNO3 D. cả B, C đúng
Đáp án C
| NaCl | NaBr | NaNO3 | NaOH | HCl | |
| Quỳ tím | - | - | - | Xanh | Đỏ |
| Dd AgNO3 | ↓ trắng | ↓ vàng nhạt | - | X | X |
NaCl + AgNO3 → AgCl↓ + NaNO3
NaBr + AgNO3 → AgBr↓ + NaNO3
Bài 29: Đặc điểm nào dưới đây là đặc điểm chung của các đơn chất halogen?
A. Ở điều kịên thường là chất khí.
B. Tác dụng mạnh với nước.
C. Vừa có tính oxi hoá, vừa có tính khử.
D. Có tính oxi hoá mạnh.
Đáp án D.
Bài 30: Phản ứng giữa hyđro và chất nào sau đây thuận nghịch?
A. Flo B. Clo. C. Iot. D. Brom.
Đáp án C
H2 + I2 to, xt, p⇔ 2HI
Bài 31: Hòa tan 12,8 gam hh Fe, FeO bằng dd HCl vừa đủ, thu được 2,24 lít (đktc). Thành phần phần trăm theo khối lượng của FeO trong hỗn hợp là:
A. 56,25% B. 43,75% C. 66,67% D. 33,33%
Đáp án A.
nHCl= 0,1 (mol)
Fe +2HCl → FeCl2 + H2
0,1 ← 0,1 (mol)
⇒ mFe = 0,1.56 = 5,6 (g)
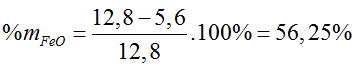
Bài 32: Dung dịch HF được dùng để khắc chữ vẽ hình lên thủy tinh nhờ phản ứng với chất nào sau đây?
A. Si B. H2O C. K D. SiO2
Đáp án D.
4HF + SiO2 → SiF4 + 2H2O
Bài 33: Cho 1,12 lít (đktc) halogen X2 tác dụng vừa đủ với đồng kim loại thu được 11,2 gam CuX2. Nguyên tố halogen là:
A. Flo B. Clo C. Brom D. Iot
Đáp án C
nX2 = 0,05 mol
Cu + X2 → CuX2
0,05 → 0,05 (mol)
MCuX2 = 11,2/0,05 = 224 ⇒ 64 +2X = 224 ⇒ X= 80 (Br)
Bài 34: Công thức phân tử của clorua vôi là
A. Cl2.CaO. B. CaOCl2. C. Ca(OH)2 và CaO. D. CaCl2.
Đáp án B.
Bài 35: Nước Gia-ven dùng để tẩy trắng vải, sợi vì có
A. Tính khử mạnh. B. Tính tẩy màu mạnh.
C. Tính axit mạnh. D. Tính oxi hóa mạnh.
Đáp án D.
Bài 36: Trong phòng thí nghiệm nước Gia-ven được điều chế bằng cách:
A. Cho khí clo tác dụng với nước.
B. Cho khí clo tác dụng với dung dịch Ca(OH)2.
C. Cho khí clo sục vào dung dịch NaOH loãng.
D. Cho khí clo vào dung dịch KOH loãng rồi đun nóng 100oC.
Đáp án C.
Cl2 + 2NaOH → NaCl + NaClO + H2O
Bài 37: Khi nung nóng, iot rắn chuyển ngay thành hơi, không qua trạng thái lỏng. Hiện tượng này được gọi là
A. Sự thăng hoa. B. Sự bay hơi.
C. Sự phân hủy. D. Sự ngưng tụ.
Đáp án A.
Bài 38: Hoà tan hoàn toàn 8,45 gam một kim loại hoá trị II bằng dung dịch HCl. Cô cạn dung dịch sau phản ứng được 17,68 gam muối khan. Kim loại đã dùng là
A. Ba. B. Zn. C. Mg. D. Ca.
Đáp án B
M + 2HCl → MCl2 + H2
M (M + 71)
8,45g 17,68g
⇒ 17,68.M = 8,45.(M + 71)
⇒ M = 65g (Zn)
Bài 39: Đốt cháy 11,9 gam hỗn hợp gồm Zn, Al trong khí Cl2 dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 40,3 gam hỗn hợp muối. Thể tích khí Cl2 (đktc) đã phản ứng là
A. 8,96 lít. B. 6,72 lít. C. 17,92 lít. D. 11,2 lít.
Đáp án A
Bảo toàn khối lượng ta có:
mKL + mClo = mmuối
⇒ 40,3 - 11,9 = 28,4 (g)
nCl2 = 28,4/71 = 0,4 mol
VCl2 = 0,4 . 22,4 = 8,96l
sc
Bài 40: Khí Cl2 không tác dụng với
A. khí O2. B. dung dịch NaOH.
C. H2O. D. dung dịch Ca(OH)2.
Đáp án A.
Cl2 + 2NaOH → NaCl + NaClO + H2O
Cl2 + H2O ⇔ HCl + HClO
Cl2 + Ca(OH)2 → CaOCl2 +H2O
Trên đây VnDoc đã giới thiệu tới các bạn lý thuyết Hóa học 10: Trắc nghiệm chương 5: Nhóm Halogen phần 2. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 10, Giải bài tập Hóa học lớp 10, Giải bài tập Vật Lí 10, Tài liệu học tập lớp 10 mà VnDoc tổng hợp và giới thiệu tới các bạn đọc.








