Trắc nghiệm chương 4: Phản ứng oxi hóa - khử phần 4
Chuyên đề Hóa học lớp 10: Trắc nghiệm chương 4: Phản ứng oxi hóa - khử phần 4 được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Bài tập trắc nghiệm chương 4
Khi cho Cu2S tác dụng với HNO3 thu được hỗn hợp sản phẩm gồm: Cu(NO3)2; H2SO4; NO và H2O.
Bài 1: Số electron mà 1 mol Cu2S đã nhường là:
A. 9 electron. B. 6 electron. C. 2 electron. D. 10 electron.
Đáp án D
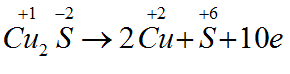
Bài 2: Hệ số cân bằng của HNO3 là:
A. 10 B. 22 C. 26 D. 1
Đáp án B

3Cu2S + 22HNO3 → 6Cu(NO3)2 + 3H2SO4 + 10NO + 8H2O
Bài 3: Cho phản ứng: Fe2+ + MnO4- + H+ → Fe3+ + Mn2+ + H2O. Sau khi cân bằng, tổng các hệ số (có tỉ lệ nguyên và tối giản nhất) là
A. 22. B. 24. C. 18. D. 16.
Đáp án B
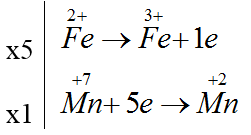
5Fe2+ + MnO4- + 8H+ → 5Fe3+ + Mn2+ + 4H2O
Tổng các hệ số (có tỉ lệ nguyên và tối giản nhất) là = 5 + 1+ 8 + 5+ 1+4 = 24
Bài 4: Trong phản ứng đốt cháy CuFeS2 tạo ra sản phẩm CuO, Fe2O3 và SO2 thì một phân tử CuFeS2 sẽ
A. nhường 12 electron. B. nhận 13 electron.
C. nhận 12 electron. D. nhường 13 electron.
Đáp án D

Bài 5: Cho quá trình: NO3- + 3e + 4H+ → NO + 2H2O. Đây là quá trình:
A. oxi hóa. B. khử. C. nhận proton. D. tự oxi hóa – khử.
Đáp án B.
Bài 6: Trong phản ứng FexOy + HNO3 → N2 + Fe(NO3)3 + H2O, một phân tử FexOy sẽ
A. nhường (2y – 3x) e.
B. nhận (3x – 2y) e.
C. nhường (3x – 2y) e.
D. nhận (2y – 3x) e.
Đáp án C.
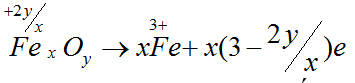
Bài 7: Trong dãy các chất sau, dãy chất nào luôn luôn là chất oxi hóa khi tham gia các phản ứng oxi hóa – khử :
A. KMnO4, Fe2O3, HNO3.
B. Fe, Fe2O3, HNO3.
C. HNO3, H2S, SO2.
D. FeCl2, I2, HNO3.
Đáp án A.
Trong các hợp chất, số oxi hóa lần lượt là: 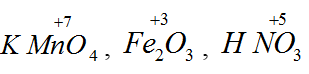
Cho sơ đồ phản ứng: Al + HNO3 → Al(NO3)3 + N2 + N2O + H2O.
Bài 8: Biết khi cân bằng tỉ lệ số mol giữa N2O và N2 là 3: 2. Tỉ lệ mol nAl : nN2O : nN2 lần lượt là
A. 44: 6: 9. B. 46: 9: 6. C. 46: 6: 9. D. 44: 9: 6.
Đáp án D
Bài 9: Hệ số của HNO3 sau khi cân bằng là:
A. 213 B. 126 C. 162 D. 132
Đáp án C.
Ta có: tỉ lệ số mol giữa N2O và N2 là 3: 2
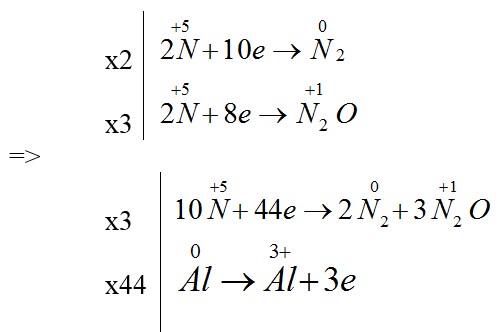
Pt sau cân bằng: 44Al + 162HNO3 → 44Al(NO3)3 + 6N2 + 9N2O + 81H2O.
Bài 10: Cho các chất và ion sau: Zn; Cl2; FeO; Fe2O3; SO2; H2S; Fe2+; Cu2+; Ag+. Số lượng chất và ion vừa đóng vai trò chất khử, vừa đóng vai trò chất oxi hóa là:
A. 2. B. 8. C. 6. D. 4.
Đáp án D.
Chất và ion vừa đóng vai trò chất khử, vừa đóng vai trò chất oxi hóa là: Cl2, FeO, SO2, Fe2+
Bài 11: Cho sơ đồ phản ứng: aFeS +bH+ + cNO3- → Fe3+ + SO42- + NO + H2O. Sau khi cân bằng, tổng hệ số a + b + c là
A. 3. B. 4. C. 6. D. 8.
Đáp án D.
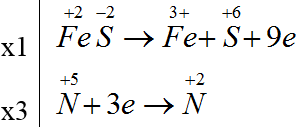
FeS + 4H+ + 3NO3- → Fe3+ + SO42- + 3NO + 2H2O
Tổng hệ số a + b + c = 1 + 4 + 3= 8
Bài 12: Hòa tan hết 1,84 gam hỗn hợp Cu và Fe trong dung dịch HNO3 dư, thu được 0,01 mol NO và 0,04 mol NO2. Số mol Fe và Cu trong hỗn hợp ban đầu lần lượt là :
A. 0,02 và 0,03. B. 0,01 và 0,02.
C. 0,01 và 0,03. D. 0,02 và 0,04.
Đáp án B.
Gọi nCu = y, nFe = x mol

Áp dụng định luật bảo toàn e ta có: 3x+2y = 0,07 (1)
Khối lượng hai kim loại = 1,84 g: 56x+64y = 1,84 (2).
Giải 1,2 ta có: x = 0,01, y = 0,02 (mol)
Bài 13: Cho dãy các chất và ion: Cl2, Br2, SO2, Na+, Ca2+, Fe2+, Al3+, Mn+, S2-, Cl-. Số chất và ion trong dãy đều có tính oxi hoá và tính khử là:
A. 3. B. 4. C. 6. D. 5.
Đáp án B.
Chất và ion vừa đóng vai trò chất khử, vừa đóng vai trò chất oxi hóa là: Cl2, SO2, Fe2+, Mn2+.
Bài 14: Cho m gam Cu phản ứng hết với dung dịch HNO3 thu được 8,96 lít (đktc) hỗn hợp khí NO và NO2 có tỉ khối đối với H2 là 19. Giá trị của m là:
A. 25,6 gam. B. 16 gam. C. 2,56 gam. D. 8 gam.
Đáp án A
Gọi nNO = x mol, nNO2 = y mol.
Ta có: x + y= 8,6/22,4 = 0,4 (1)
30x + 46y = 19.2.0,4 (2)
Giải 1,2 ta có x = 0,2, y = 0,2 mol.
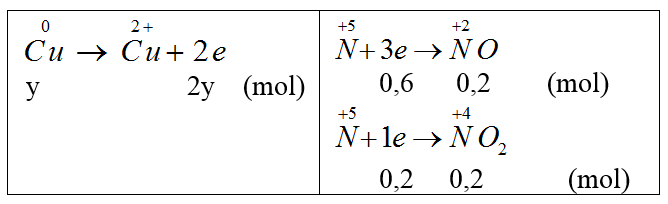
Bảo toàn e: 2y = 0,8 ⇒ y = 0,4 (mol). ⇒ mCu = 0,4.64 = 25,6 (g).
Bài 15: Cho từng chất : Fe, FeO, Fe(OH)2, Fe3O4, Fe2O3, Fe(NO3)3, Fe(NO3)2, FeSO4, Fe2(SO4)3, FeCO3 lần lượt phản ứng với HNO3 đặc nóng. Số lượng phản ứng thuộc loại phản ứng oxi hoá – khử là:
A. 8. B. 6. C. 5. D. 7.
Đáp án D.
Số lượng phản ứng thuộc loại phản ứng oxi hoá – khử xảy ra giữa HNO3 với lần lượt các chất: Fe, FeO, Fe(OH)2, Fe3O4,Fe(NO3)2, FeSO4,FeCO3. (Hợp chất mà trong đó Fe chưa đạt số oxi hóa là +3).
Bài 16: Xét phản ứng sau:
3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O (1);
2NO2 + 2KOH → KNO2 + KNO3 + H2O (2)
Phản ứng (1), (2) thuộc loại phản ứng
A. oxi hóa – khử nội phân tử.
B. oxi hóa – khử nhiệt phân.
C. tự oxi hóa – khử.
D. không oxi hóa – khử.
Đáp án C.
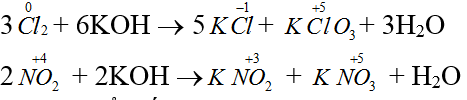
Sự thay đổi số oxi hóa xảy ra chỉ trên 1 nguyên tố là phản ứng tự oxi hóa – khử.
Bài 17: Hòa tan 4,59 gam Al bằng dung dịch HNO3 dư thu được hỗn hợp khí NO và N2O có tỉ khối hơi đối với hiđro bằng 16,75 (ngoài ra không có sản phẩm khử nào khác). Thể tích (đktc) NO và N2O thu được lần lượt là:
A. 2,24 lít và 6,72 lít.
B. 2,016 lít và 0,672 lít.
C. 0,672 lít và 2,016 lít.
D. 1,972 lít và 0,448 lít.
Đáp án B
nAl = 0,17 (mol).
Gọi nNO = x mol, nN2O = y mol
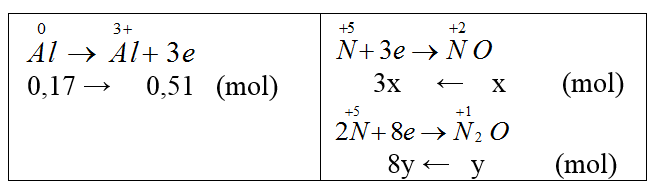
Bảo toàn e: 3x + 8y = 0,51 (1)
Mhh = 16,75.2 = 33,5 = (30x + 44y)/(x+y) (2)
Giải 1 và 2 ta có: x =0,09 (mol); y = 0,03 (mol)
VNO = 0,09.22,4 = 2,016 (l), VN2O = 0,672 (l)
Cho các phản ứng oxi hoá – khử sau:
(1) 3I2 + 3H2O → HIO3 + 5HI (2) 2HgO → 2Hg + O2
(3) 4K2SO3 → 3K2SO4 + K2S (4) NH4NO3 → N2O + 2H2O
(5) 2KClO3 → 2KCl + 3O2 (6) 3NO2 + H2O → 2HNO3 + NO
(7) 4HClO4 → 2Cl2 + 7O2 + 2H2O (8) 2H2O2 → 2H2O + O2
(9) Cl2 + Ca(OH)2 → CaOCl2 + H2O (10) 2KMnO4 → K2MnO4 + MnO2 + O2
Bài 18: Trong số các phản ứng oxi hoá – khử trên, số phản ứng oxi hoá – khử nội phân tử là:
A. 2. B. 3. C. 4. D. 5.
Đáp án D
Bài 19: Trong số các phản ứng oxi hoá – khử trên, số phản ứng tự oxi hoá – khử là :
A. 6. B. 7. C. 4. D. 5.
Đáp án D
Phản ứng oxi hóa khử nội phân tử là phản ứng mà sự thay đổi số oxi hóa xảy ra tại các nguyên tố trong cùng 1 phân tử. Các phản ứng oxi hóa – khử nội phân tử là: 2, 5, 7, 8, 9
Phản ứng tự oxi hóa – tự khử là phản ứng sự tăng giảm số oxi hóa xảy ra trên cùng một nguyên tố.
Các phản ứng oxi hóa – khử nội phân tử là: 1, 3, 4, 6, 10
Bài 20: Cho sơ đồ phản ứng : Cu2S + HNO3 → Cu(NO3)2 + H2SO4 + NO2 + H2O
Hệ số cân bằng của Cu2S và HNO3 trong phản ứng là:
A. 1 và 22. B. 1 và 14. C. 1 và 10. D. 1 và 12.
Đáp án B
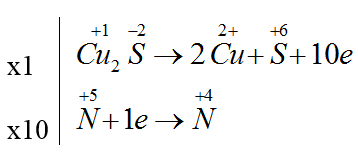
Cu2S + 14HNO3 → 2Cu(NO3)2 + H2SO4 + 10NO2 + 6H2O
Bài 21: Hoà tan 2,64 gam hỗn hợp Fe và Mg bằng dung dịch HNO3 loãng, dư, chỉ thu được sản phẩm khử là 0,896 lít (đktc) hỗn hợp khí gồm NO và N2, có tỉ khối so với H2 bằng 14,75. % theo khối lượng của sắt trong hỗn hợp ban đầu là:
A. 61,80%. B. 61,82%. C. 38,18%. D. 38,20%.
Đáp án C
nNO = x mol, nH2 = y mol
x + y= 0,896/22,4 = 0,04 mol (1)
30x + 28y = mhh = 14,75.2.0,04 (2)
Giải 1,2 ta có x = 0,03, y =0,01 (mol)
Gọi nFe = a mol, nMg = b mol.
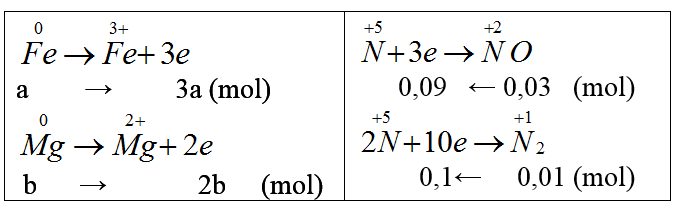
Ta có: 56a + 24b = 2,64 (*)
3a + 2b = 0,19 (**) (Bảo toàn e).
Giải (*), (**): a = 0,018 mol; b = 0,068 mol.
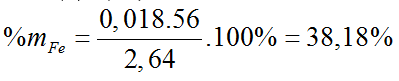
Bài 22: Có phản ứng: X + HNO3 → Fe(NO3)3 + NO + H2O. Số chất X có thể thực hiện phản ứng trên là:
A. 3. B. 4. C. 5. D. 6
Đáp án C
X là các hợp chất của Fe+2: Fe(NO3)2, FeO, Fe(OH)2 và Feo , Fe3O4
Bài 23: Cho sơ đồ phản ứng: Fe3O4 + HNO3 → Fe(NO3)3 + NO + H2O.
Sau khi cân bằng, tỉ lệ giữa số phân tử bị oxi hoá và số phân tử bị khử là
A. 3:1. B. 28:3. C. 3:28. D. 1:3.
Đáp án A.
Ta có các quá trình:
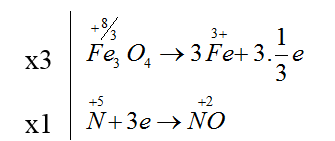
3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O
Chất khử chất oxi hóa (số phân tử HNO3 đóng vai trò làm chất oxi hóa là 1).
Fe3O4 là chất bị oxi hóa, HNO3 vừa là môi trường vừa là chất bị khử.
Bài 24: Cho 9,2 gam hỗn hợp gồm Zn và Al phản ứng hoàn toàn với lượng dư dung dịch H2SO4 đặc, nóng thu được 5,6 lít khí SO2 (ở đktc, là sản phẩm khử duy nhất). Khối lượng Al có trong hỗn hợp là
A. 2,7 gam. B. 5,4 gam C. 8,1 gam. D. 6,75 gam.
Đáp án A
nSO2 = 5,6/22,4 = 0,25 mol
Gọi nAl = a mol, nZn = b mol.
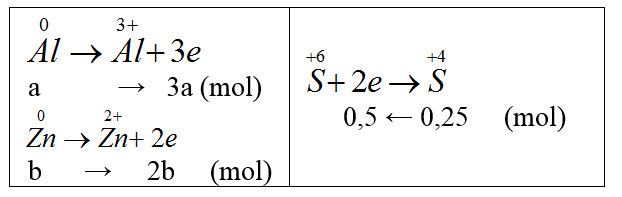
Ta có: 27a + 65b = 9,2 (*)
3a + 2b = 0,5 (**)
Giải (*), (**): a = b = 0,1 mol.
mAl = 0,1.27 = 2,7 gam
Bài 25: Hoà tan hoàn toàn 2,16 gam kim loại M hóa trị III bởi lượng dư dung dịch H2SO4 đặc, nóng thu được 2,688 gam khí SO2 (là sản phẩm khử duy nhất). M là
A. Fe. B. Cu. C. Zn. D. Al.
Đáp án D.
nSO2 = 2,688/22,4 = 0,12 mol
Ta có:
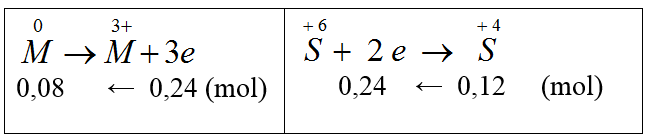
MM = 2,16/0,08 = 27 (Al)
Trên đây VnDoc đã giới thiệu tới các bạn lý thuyết Hóa học 10: Trắc nghiệm chương 4: Phản ứng oxi hóa - khử phần 4. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 10, Giải bài tập Hóa học lớp 10, Giải bài tập Vật Lí 10, Tài liệu học tập lớp 10 mà VnDoc tổng hợp và giới thiệu tới các bạn đọc.








