Hóa học 10 bài 15: Hóa trị và số oxi hóa
Chuyên đề Hóa học lớp 10: Hóa trị và số oxi hóa được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Lý thuyết: Hóa trị và số oxi hóa
A/ Lý thuyết Hóa học 10 bài 15
I. Hóa trị
a/ Hóa trị trong hợp chất ion
-Trong các hợp chất ion, hóa trị của 1 nguyên tố bằng điện tích của ion và được gọi là điện hóa trị của nguyên tố đó.
Ví dụ: Trong hợp chất NaCl, Na có điện hóa trị 1+ và Cl có điện hóa trị 1–
Trong hợp chất CaF2, Ca có điện hóa trị 2+ và F có điện hóa trị 1–
- Quy ước, khi viết điện hóa trị của nguyên tố, ghi giá trị điện tích trước, dấu của điện tích sau.
- Các nguyên tố kim loại thuộc nhóm IA, IIA, IIIA có số electron ở lớp ngoài cùng là 1, 2, 3 có thể nhường nên có điện hóa trị là 1+, 2+, 3+
- Các nguyên tố phi kim thuộc nhóm VIA, VIIA nên có 6, 7 electron lớp ngoài cùng, có thể nhận thêm 2 hay1 electron vào lớp ngoài cùng, nên có điện hóa trị 2–, 1–
b/ Hóa trị trong hợp chất cộng hóa trị
Quy tắc: Trong các hợp chất cộng hóa trị, hóa trị của 1 nguyên tố được xác định bằng số liên kết cộng hóa trị của nguyên tử nguyên tố đó trong phân tử và được gọi là cộng hóa trị của nguyên tố đó.
Ví dụ: Hoá trị các nguyên tố trong phân tử nước và metan
H – O – H
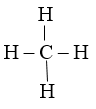
Trong H2O: Nguyên tố H có cộng hóa trị 1, nguyên tố O có cộng hóa trị 2
Trong CH4: Nguyên tố C có cộng hóa trị hóa trị 4, nguyên tố H có cộng hóa trị 1
II. Số oxi hóa
a/ Số OXH của 1 nguyên tố trong phân tử là điện tích của nguyên tử nguyên tố đó trong phân tử, nếu giả định rằng mọi liên kết trong phân tử đều là liên kết ion.
b/ Các quy tắc xác định số OXH
Quy tắc 1: Số OXH của các nguyên tố trong các đơn chất bằng không
Quy tắc 2: Trong 1 phân tử, tổng số OXH của các nguyên tố bằng 0
Quy tắc 3: Số OXH của các ion đơn nguyên tử bằng điện tích của ion đó. Trong ion đa nguyên tử, tổng số OXH của các nguyên tố bằng điện tích của ion.
Quy tắc 4: Trong hầu hết các hợp chất, số OXH của H bằng +1, trừ 1 số trường hợp như hidrua, kim loại (NaH , CaH2 ….). Số OXH của O bằng –2 trừ trường hợp OF2 , peoxit (chẳng hạn H2O2 …)
Lưu ý: Số OXH được viết bằng chữ số thường dấu đặt phía trước và được đặt ở trên kí hiệu nguyên tố.
Ví dụ: Tính oxi hóa của nguyên tố nitơ trong amoniac NH3
Đặt x là số oxi hóa của nguyên tố nitơ
Ta có x+3.1=0 ⇒ x= -3. Số OXH của N trong NH3 là -3
B/ Trắc nghiệm Hóa học 10 bài 15
Câu 1: Số oxi hóa của một nguyên tố là:
A. Điện tích của nguyên tử nguyên tố đó trong phân tử nếu giả định liên kết giữa các nguyên tử trong phân tử là liên kết ion
B. Cộng hóa trị của nguyên tố đó trong hợp chất cộng hóa trị
C. Hóa trị của nguyên tố đó
D. Điện hóa trị của nguyên tố đó trong hợp chất ion
Câu 2: Chỉ ra nội dung sai khi hoàn thành câu sau : “Trong tất cả các hợp chất,...”
A. Kim loại kiềm luôn có số oxi hoá +1
B. Halogen luôn có số oxi hoá –1.
C. Hiđro hầu hết có số oxi hoá +1, trừ một số trường hợp như hiđrua kim loại (NaH, CaH2....).
D. Kim loại kiềm thổ luôn có số oxi hoá +2.
Câu 3: Trong phân tử NaCl, điện hóa trị của Na và Cl lần lượt là
A. +1 và -1
B. +1 và +1
C. -1 và -1
D. -1 và +1
Câu 4: Cộng hóa trị của nito trong hợp chất nào sau đây là lớn nhất?
A. NH3
B. NO
C. HNO3
D. N2
Câu 5: Trong phân tử H2O2 và O2, cộng hóa trị của O lần lượt là
A. 2 và 0
B. 2 và 2
C. 1 và 0
D. 1 và 2
Câu 6: Chỉ ra nội dung sai?
A. Số oxi hóa của nguyên tố trong các hợp chất bằng hóa trị của nguyên tố đó
B. Trong một phân tử, tổng số oxi hóa của các nguyên tố bằng không
C. Số oxi hóa của ion đơn nguyên tử bằng điện tích của ion đó
D. Tổng số oxi hóa của các nguyên tố trong ion đa nguyên tử bằng điện tích của ion đó
Câu 7: Nguyên tố R là phi kim thuộc nhóm A. Hợp chất của R với hidro là RH3. Hóa trị với số oxi hóa của R trong oxit tương úng với hóa trị cao nhất lần lượt là
A. 3 và -3
B. 5 và -5
C. 5 và +5
D. 3 và +3
Câu 8: Phát biểu nào sau đây luôn đúng?
A. Số oxi hóa của oxi trong hợp chất luôn là -2
B. Số oxi hóa của oxi luôn là +1 trong tất cả các hợp chất
C. Tổng số oxi hóa các nguyên tử trong ion bằng không
D. Số oxi hóa của nguyên tố trong đơn chất bằng không
Câu 9: Nguyên tố R có cấu hình electron lớp ngoài cùng là ns2np4. Công thức hợp chất của R với H và công thức oxit tương ứng với hóa trị cao nhất của R lần lượt là
A. RH2 và RO
B. RH2 và RO2
C. RH4 và RO2
D. RH2 và RO3
Câu 10: Chọn phát biểu đúng trong các phát biểu sau:
A. Số oxi hóa của cacbon trong hợp chất hữu cơ luôn bằng +4
B. Số oxi hóa của cacbon trong hợp chất hữu cơ luôn bằng -4
C. Trong một hợp chất, nguyên tử của nguyên tố có độ âm điện lớn hơn sẽ mang oxi hóa dương và ngược lại
D. Trong một hợp chất, tổng số oxi hóa các nguyên tử bằng không
Câu 11: Hóa trị với số oxi hóa của N trong phân tử HNO3 lần lượt là
A. 3 và -3
B. 5 và -5
C. 4 và +5
D. 3 và +3
Câu 12: Hóa trị trong hợp chất ion được gọi là
A. Điện hóa trị
B. Cộng hóa trị
C. Số oxi hóa
D. Điện tích ion
Câu 13: Hóa trị và số oxi hóa của N trong phân tử NH4Cl lần lượt là
A. 4 và -3
B. 3 và +5
C. 5 và +5
D. 3 và -3
Câu 14: Dãy các chất nào dưới đây được sắp xếp theo chiều tăng dần số oxi hóa của nitơ?
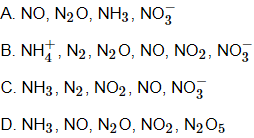
Câu 15: Cho một số hợp chất: H2S, H2SO3, H2SO4, NaHS, Na2SO3, SO3, K2S, SO2. Dãy các chất trong đó lưu huỳnh có cùng số oxi hóa là
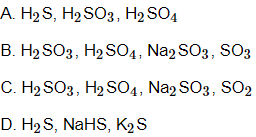
Câu 16: Nguyên tố nào sau đây không thể có số oxi hóa dương?
A. F
B. Cl
C. Br
D. I
Câu 17: Số oxi hóa của nguyên tố Mn trong hợp chất K2MnO4 là:
A. +7
B. 7+
C. +6
D. 6+
Câu 18: Số oxi hóa của cacbon trong -COOH là:
A. +3
B. +1
C. -3
D. Kết quả khác
Câu 19: Điện hóa trị của nguyên tố Cl trong hợp chất CaCl2 là:
A. -1
B. +1
C. 1-
D. 1+
Câu 20: Hợp chất Q được tạo thành bởi hai nguyên tố X và Y. Trong đó, X, Y có số oxi hóa cao nhất trong các oxit là +nO, +mO và có số oxi hóa âm trong các hợp chất khí với hidro a -nH và -mH. Biết rằng: |nO|= |nH| và |mO|= |3mH|. Mặt khác, Y có số oxi hóa cao nhất trong Q. Công thức phân tử của Q là:
A. X2Y
B. XY2
C. XY
D. X2Y5
Câu 21: Nhận định nào chưa chính xác về số oxi hóa:
A. Đơn chất luôn có số oxi hóa bằng 0
B. Trong hợp chất, tổng số oxi hóa của các nguyên tố bằng 0
C. Trong hợp chất, kim loại luôn có số oxi hóa dương bằng hóa trị của chúng
D. Trong hợp chất, phi kim luôn có số oxi hóa âm và giá trị bằng hóa trị của chúng
Câu 22: Biết nguyên tử X có 2 (e) hóa trị và nguyên tử Y có 5 (e) hóa trị. Công thức hợp chất tạo bởi X và Y là:
A. XY2
B. X3Y2
C. X2Y3
D. X2Y
Câu 23:Trong hợp chất cộng hóa trị, hóa trị của một nguyên tố:
A. Bằng số liên kết của nguyên tử nguyên tố đó tạo ra được với các nguyên tử khác trong phân tử và được gọi là cộng hóa trị của nguyên tố đó
B. Bằng số liên kết của nguyên tử nguyên tố đó trong phân tử và được gọi là điện hóa trị của nguyên tố đó
C. Bằng số electron liên kết với nguyên tử của nguyên tố khác trong phân tử
D. Bằng số liên kết của nguyên tử nguyên tố đó với nguyên tử gần nhất
Câu 24: Sơ đồ nào sau đây biểu diễn quá trình biến đổi đúng?
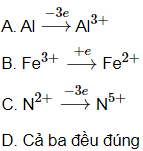
Câu 25: Chọn nội dung đúng để hoàn thành câu sau: “Trong tất cả các hợp chất,...”
A. Số oxi hóa của hiđro luôn bằng +1.
B. Số oxi hóa của natri luôn bằng +1.
C. Số oxi hóa của oxi luôn bằng –2.
D. Tất cả đáp án đều đúng
Đáp án
| 1A | 2B | 3A | 4C | 5B | 6A | 7C | 8D | 9D | 10D |
| 11C | 12A | 13A | 14B | 15D | 16A | 17C | 18A | 19C | 20B |
| 21D | 22C | 23A | 24C | 25C |
-----------------------------------------
Trong phần chuyên đề trên đây chúng ta có thể hiểu biết thêm về Hóa trị và số oxi hóa gồm các khái niệm về hóa trị, hóa trị trong hợp chất ion, hóa trị trong hợp chất cộng hóa trị....
Như vậy VnDoc đã giới thiệu các bạn tài liệu Lý thuyết Hóa học lớp 10 bài 15: Hóa trị và số oxi hóa. Mời các bạn tham khảo thêm tài liệu: Trắc nghiệm Sinh học 10, Giải bài tập Sinh học lớp 10, Giải Vở BT Sinh Học 10, Giải bài tập Sinh học 10 ngắn nhất, Tài liệu học tập lớp 10.
Để tiện trao đổi, chia sẻ kinh nghiệm về giảng dạy và học tập các môn học lớp 10, VnDoc mời các thầy cô giáo, các bậc phụ huynh và các bạn học sinh truy cập nhóm riêng dành cho lớp 10 sau: Nhóm Tài liệu học tập lớp 10. Rất mong nhận được sự ủng hộ của các thầy cô và các bạn.








