Hóa học 10 bài 4: Cấu tạo vỏ nguyên tử
Chúng tôi xin trân trọng giới thiệu bài Lý thuyết Hóa học lớp 10 bài 4: Cấu tạo vỏ nguyên tử được VnDoc sưu tầm và tổng hợp các câu hỏi lí thuyết và trắc nghiệm có đáp án đi kèm nằm trong chương trình giảng dạy môn Hóa học lớp 10. Mời quý thầy cô cùng các bạn tham khảo tài liệu dưới đây.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết
Lý thuyết: Cấu tạo vỏ nguyên tử
A/ Lý thuyết Hóa học 10 bài 4
I. Sự chuyển động của electron trong nguyên tử
1/ Sự chuyển động của electron trong nguyên tử
Trong nguyên tử, các electron chuyển động rất nhanh xung quanh hạt nhân không theo quỹ đạo xác định nào và tạo thành đám mây electron.
2/ Obitan nguyên tử (AO)
a/ Định nghĩa: Obitan nguyên tử là khu vực đám mây electron xung quanh hạt nhân mà xác suất có mặt electron khoảng 90%.
b/ Hình dạng obitan nguyên tử: Dựa trên sự khác nhau về trạng thái electron trong nguyên tử ta có:
- Obitan s: dạng hình cầu.
- Obitan p: gồm 3 obitan px, py, pz có hình dạng số 8 nổi, định hướng theo 3 trục Ox, Oy, Oz của hệ tọa độ.
II. Lớp electron và Phân lớp electron
1/ Lớp electron: Lớp electron gồm các electron có mức năng lượng gần bằng nhau. Các lớp electron xếp theo thứ tự mức năng lượng từ thấp đến cao (từ gần nhân ra ngoài):
| Lớp thứ n | 1 | 2 | 3 | 4 | 5 | 6 | 7 | |
| Tên lớp | K | L | M | N | O | P | Q | |
| Có số obitan là n2 | 1 | 4 | 9 | 16 | ||||
| Có số electron tối đa là 2n2 | 2 | 8 | 18 | 32 |
2/ Phân lớp electron
- Mỗi lớp electron chia thành các phân lớp s, p, d, f gồm các electron có mức năng lượng bằng nhau:
| Phân lớp | s | p | d | f |
| Có số obitan | 1 | 3 | 5 | 7 |
| Có số electron tối đa | 2 | 6 | 10 | 14 |
- Trong 1 lớp electron thì số phân lớp = số thứ tự lớp:
| Lớp thứ | 1 | 2 | 3 | 4 |
| Có phân lớp | 1s | 2s2p | 3s3p3d | 4s4p4d4f |
- Phân lớp electron chứa electron tối đa gọi là phân lớp electron bão hòa.
Trong phần chuyên đề trên đây chúng ta có thể hiểu biết thêm về Cấu tạo vỏ nguyên tử gồm các khái niệm về sự chuyển động của electron trong nguyên tử, các lớp electron và phân lớp electron.
B/ Trắc nghiệm Hóa học 10 bài 4
Câu 1: Trong các khẳng định sau, khăng định nào đúng
A. Các electron có mức năng lượng bằng nhau được xếp vào cùng một lớp
B. Các electron có mức năng lượng bằng nhau được xếp vào cùng một phân lớp
C. Các electron có mức năng lượng gần bằng nhau được xếp vào cùng một phân lớp
D. Các electron có mức năng lượng khác nhau được xếp vào cùng một lớp
Câu 2: Phân bố electron trên các lớp K/L/M/N của nguyên tố asen lần lượt là 2/8/18/5. Phát biểu nào sau đây là sai?
A. Lớp ngoài cùng của asen có 2 electron s.
B. Điện tích hạt nhân asen là 33+.
C. Tổng số electron p của nguyên tử asen là 12.
D. Tổng số electron d của nguyên tử asen là 10.
Câu 3: Nguyên tử nguyên tố X có 19 electron. Ở trạng thái cơ bản, X có số obitan chứa electron là
A. 9 B. 8 C. 10 D. 11
Câu 4: Nguyên tử nào sau đây có 8 electron ở lớp ngoài cùng?
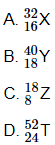
Câu 5: Các obitan trong cùng một phân lớp electron
A. Có cùng định hướng trong không gian
B. Có cùng mức năng lượng
C. Khác nhau về mức năng lượng
D. Có hình dạng không phụ thuộc vào đặc điểm của mỗi phân lớp
Câu 6: Cho các nguyên tử: ![]()
Phát biểu nào sau đây là đúng?
A. Số electron trên phân lớp s của Z lớn hơn số electron trên phân lớp s của Y.
B. X, Y, Z có cùng số electron ở lớp ngoài cùng.
C. Tổng số electron trên phân lớp s của X và Z bằng nhau.
D. Tổng số electron p của Y là lớn nhất.
Câu 7: Nguyên tố có Z= 12 thuộc loại nguyên tố nào?
A. s B. p C. d D. f
Câu 8: Một nguyên tử có 14 electron. Số electron p của nguyên tử này là
A. 2. B. 4. C. 6. D. 8.
Câu 9: Obitan nguyên tử là gì?
A. Là quỹ đạo chuyển động của electron xung quanh hạt nhân
B. Là khu vực có chứa electron xung quanh hạt nhân nguyên tử
C. Là vùng không gian xung quanh nguyên tử, ở đó xác suất có mặt electron lớn nhất
D. Cả ba đáp án trên sai
Câu 10: Một nguyên tử có 17 electron. Số phân lớp electron của nguyên tử này là
A. 4. B. 5. C. 6. D. 7.
Câu 11: Obitan pz có dạng hình số 8 nổi cân đối. Obitan này định hướng theo trục nào?
A. Trục x
B. Trục y
C. Không định hướng theo trục nào
D. Trục z
Câu 12: Một nguyên tử có 4 lớp electron, số electron ở lớp ngoài cùng là 7, các lớp trong đều đã bão hòa electron. Số hiệu nguyên tử của nguyên tố này là
A. 35. B. 25. C. 17. D. 7
Câu 13: Khi nói về mức năng lượng các electron trong nguyên tử, điều khẳng định nào sau đây là không đúng?
A. Các (e) ở tronng cùng lớp K có mức năng lượng bằng nhau
B. Các (e) ở lớp ngoài cùng có mức năng lượng trung bình cao nhất
C. Các (e) ở lớp K có mức năng lượng cao nhất
D. Các (e) ở lớp K có mức năng lượng thấp nhất
Câu 14: Một nguyên tử có 19 electron. Số electron ở lớp ngoài cùng của nguyên tử này là
A. 1. B. 2. C. 3. D. 4.
Câu 15: Lớp electron thứ 5 được kí hiệu bằng các chữ cái in hoa nào sau đây?
A. M B. N C. O D. P
Câu 16: Lớp M (n=3) có số obitan nguyên tử là bao nhiêu?
A. 1 B. 4 C. 9 D. 15
Câu 17: Trong cấu hình electron của nguyên tử R có electron ngoài cùng được biểu diễn bằng 4 số lượng tử: n= 3, l= 1, m= 0, ms= −1/2. Nguyên tử R có tên là:
A. Brom B. Photpho C. Nhôm D. Clo
Câu 18: Một nguyên tử có 3 lớp electron, trong đó số electron p bằng số electron s. Số electron ở lớp ngoài cùng của nguyên tử này là
A. 2 .B. 4. C. 6. D. 8.
Câu 19: Nguyên tử của nguyên tố X có 13 electron. Khi mất đi toàn bộ electron ở lớp ngoài cùng, điện tích của ion tạo thành là
A. 1+. B. 2+ C. 3+. D. 4+.
Câu 20: Tổng số hạt (nơtron, proton, electron) trong nguyên tử của hai nguyên tố M và X lần lượt là 82 và 52. M và X tạo thành hợp chất MXa có tổng số proton bằng 77. Giá trị của a là
A. 1. B. 2. C. 3. D. 4.
Câu 21: Các electron của nguyên tố X được phân bố trên 3 lớp, lớp thứ 3 có 6 electron. Số đơn vị điện tích hạt nhân của nguyên tử nguyên tố X là
A. 6 B. 8 C. 14 D. 16
Câu 22: Hình dạng của obitan p là gì?
A. Hình tròn
B. Hình số 8 nổi cân đối
C. Hình cầu
D. Hình bầu dục
Câu 23: Ứng với lớp M(n = 3) có bao nhiêu phân lớp
A. 3 B. 4 C.6 D.9
Câu 24: Cho các phát biểu sau:
a. Các electron thuộc các obitan 2px, 2py, 2pz có năng lượng như nhau.
b. Các electron thuộc các obitan 2px, 2py, 2pz chỉ khác nhau về định hướng trong không gian.
c. Năng lượng của các electron thuộc các phân lớp 3s, 3p, 3d là khác nhau.
d. Năng lượng của các electron thuộc các obitan 2s và 2px là như nhau.
e. Phân lớp 3d đã bão hòa khi đã xếp đầy 10 electron.
Các khẳng định đúng là:
A. a, b, c
B. b và c
C. a, b, e
D. a, b, c, e
Câu 25: Về mức năng lượng của các electron trong nguyên tử, điều khẳng định nào sau đây là sai?
A. Các electron ở lớp K có mức năng lượng thấp nhất.
B. Các electron ở lớp ngoài cùng có mức năng lượng trung bình cao nhất.
C. Các electron ở lớp K có mức năng lượng cao nhất.
D. Các electron ở lớp K có mức năng lượng gần bằng nhau.
Đáp án
| 1-B | 2-C | 3-C | 4-B | 5-B | 6-D | 7-A | 8-D | 9-C | 10-B |
| 11-D | 12-A | 13-C | 14-A | 15-C | 16-C | 17-D | 18-A | 19-C | 20-C |
| 21-D | 22-B | 23-A | 24-D | 25-C |
-----------------------------------------
Với nội dung bài Hóa học 10 bài 4: Cấu tạo vỏ nguyên tử các bạn học sinh cùng quý thầy cô cần nắm vững kiến thức về khái niệm, đặc điểm và tính chất, cấu tạo của vỏ nguyên tử...
Như vậy VnDoc đã giới thiệu các bạn tài liệu Lý thuyết Hóa học lớp 10 bài 4: Cấu tạo vỏ nguyên tử. Mời các bạn tham khảo thêm tài liệu: Trắc nghiệm Sinh học 10, Giải bài tập Sinh học lớp 10, Giải Vở BT Sinh Học 10, Giải bài tập Sinh học 10 ngắn nhất, Tài liệu học tập lớp 10.
Để tiện trao đổi, chia sẻ kinh nghiệm về giảng dạy và học tập các môn học lớp 10, VnDoc mời các thầy cô giáo, các bậc phụ huynh và các bạn học sinh truy cập nhóm riêng dành cho lớp 10 sau: Nhóm Tài liệu học tập lớp 10. Rất mong nhận được sự ủng hộ của các thầy cô và các bạn.








