Brom
Chuyên đề Hóa học lớp 10: Brom được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Lý thuyết: Brom
I. Trạng thái tự nhiên
- Tồn tại ở dạng hợp chất, chủ yếu là muối bromua của kali, natri, magie.
- Bromua kim loại có trong nước biển, nước của 1 số hồ cùng với muối clorua.
II. Tính chất của brom
1. Tính chất vật lý
- Brom là chất lỏng màu đỏ nâu, mùi khó chịu, dễ bay hơi, độc.
- Là chất ôxi hóa yếu hơn clo.
2. Tính chất hóa học
a. Tác dụng với kim loại
Sản phẩm tạo muối tương ứng
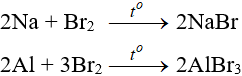
b. Tác dụng với hidro
![]()
Độ hoạt động giảm dần từ Cl → Br → I
Các khí HBr, HI tan vào nước tạo dung dịch axit.
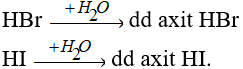
Về độ mạnh axit thì lại tăng dần từ HCl < HBr < HI.
c. Tính khử của Br2, HBr
- Brom thể hiện tính khử khi gặp chất oxi hóa mạnh (như nước clo, …)
Br2 + 5Cl2 + 6H2O → 2HBrO3 (Axit bromic) + 10HCl
- Tính khử của HBr (ở trạng thái khí cũng như trong dd) mạnh hơn HCl. HBr khử được H2SO4 đặc thành SO2.
2HBr + H2SO4đ → Br2 + SO2 + 2H2O
- Dd HBr không màu, để lâu trong không khí trở nên có màu vàng nâu vì bị oxi hóa (dd HF và HCl không có phản ứng này):
4HBr + O2 → 2H2O + 2Br2
III. Ứng dụng, điều chế
1. Ứng dụng
- Brom dùng để chế tạo 1 số dược phẩm, phẩm nhuộm, …
- Dùng chế tạo AgBr chất dùng để tráng lên phim ảnh.
2. Điều chế
- Nguồn chính để điều chế brom là nước biển.
- Điều chế brom dựa trên sự oxi hóa ion Br-, chất oxi hóa là clo.
![]()
IV. Một số hợp chất của brom
1. Hidro bromua và axit bromhidric
- Ở nhiệt độ thường, HBr là chất khí, không màu, "bốc khói" trong không khí ẩm và rất dễ tan trong nước.
- Dung dịch HBr trong nước được gọi là dung dịch axitbromhiđric. Axitbromhiđric là một axit mạnh, mạnh hơn axit clohiđric.
- Tính khử:
HBr có tính khử mạnh hơn HCl, HBr khử được H2SO4 đặc thành SO2.
![]()
Dung dịch HBr không màu, để lâu trong không khí trở nên có màu vàng nâu vì bị oxi hóa (dung dịch HF và HCl không có phản ứng này):
![]()
2. Hợp chất chứa oxi của brom
- Axit hipobromo (HBrO) có tính bền, tính oxi hóa và tính axit kém HClO.
![]()
- Axit bromic (HBrO3).
- Axit pebromic (HBrO4).
Tương tự như clo, trong các hợp chất với oxi brom thể hiện số oxi hóa dương (+1, +3, +5, +7).
Trong phần chuyên đề trên đây chúng ta có thể hiểu biết thêm về Brom gồm các phản ứng hóa học, cấu hình nguyên tử, điều chế brom trong phòng thí nghiệm và thực tế...
Trên đây VnDoc đã giới thiệu tới các bạn lý thuyết Hóa học 10: Brom. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 10, Giải bài tập Hóa học lớp 10, Giải bài tập Vật Lí 10, Tài liệu học tập lớp 10 mà VnDoc tổng hợp và giới thiệu tới các bạn đọc.








