Hóa học 10 bài 36: Tốc độ phản ứng hóa học
Chuyên đề Hóa học lớp 10: Tốc độ phản ứng hóa học được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Lý thuyết: Tốc độ phản ứng hóa học
A/ Lý thuyết Hóa học 10 bài 36
I. Khái niệm về tốc độ phản ứng hóa học
1. Tốc độ phản ứng
- Tốc độ phản ứng là độ biến thiên nồng độ của một chất trong các phản ứng hoặc sản phẩm trong một đơn vị thời gian. Trong đó theo quy ước: nồng độ theo mol/lít, thời gian có thể là giây (s), phút (ph), giờ (h)... Tốc độ phản ứng được xác định bằng thực nghiệm.
2. Tốc độ trung bình
- Tốc độ trung bình của phản ứng hóa học là tốc độ biến thiên trung bình nồng độ của một chất trong khoảng thới gian t1 đến t2.
Ví dụ: Xét phản ứng aA → bB
Nếu tính tốc độ phản ứng theo chất A: Ở thời điểm t1 chất A có nồng độ C1 mol/lít, ở thời điểm t2 chất A có nồng độ C2 mol/lít. Tốc độ trung bình của phản ứng là:
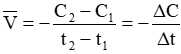
Còn nếu tính tốc độ phản ứng theo chất B thì tốc độ trung bình của phản ứng là:
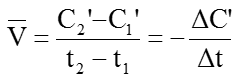
Để tốc độ phản ứng là đơn giá trị người ta sử dụng biểu thức:
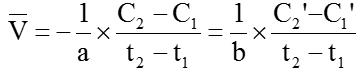
II. Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
- Khi tăng nồng độ của chất phản ứng thì tốc độ phản ứng tăng.
- Đối với các phản ứng hóa học có chất khí tham gia, khi tăng áp suất thì tốc độ phản ứng tăng.
- Khi tăng nhiệt độ thì tốc độ phản ứng tăng.
- Đối với các phản ứng hóa học có chất rắn tham gia thì khi tăng diện tích bề mặt, tốc độ phản ứng tăng.
- Chất xúc tác làm tăng tốc độ phản ứng, nhưng không tiêu hao trong quá trình phản ứng.
- Chất ức chế phản ứng là chất làm giảm tốc độ phản ứng, nhưng không bị tiêu hao trong quá trình phản ứng.
III. Ý nghĩa thực tiễn của tốc độ phản ứng
Các yếu tố ảnh hưởng đến tốc độ phản ứng được vận dụng nhiều trong đời sống và sản xuất.
Ví dụ: Thực phẩm nấu trong nồi áp suất nhanh chín hơn khi nấu áp suất thường.
Các chất đốt như than, củi cháy nhanh hơn khi có kích thước nhỏ.
B/ Trắc nghiệm Hóa học 10 bài 36
Câu 1: Phương án nào dưới đây mô tả đầy đủ nhất các yếu tố ảnh hưởng đến tốc độ phản ứng?
A. Nồng độ,nhiệt độ, chất xúc tác
B. Nồng độ,nhiệt độ, chất xúc tác, áp suất
C. Nồng độ,nhiệt độ, chất xúc tác,áp suất, khối lượng chất rắn
D. Nồng độ,nhiệt độ, chất xúc tác,áp suất, diện tích bề mặt chất rắn
Câu 2: Trong phản ứng điều chế khí oxi trong phòng thí nghiệm bằng cách nhiệt phân muối kali clorat, những biện pháp nào dưới đây được sử dụng nhằm mục đích tăng tốc độ phản ứng?
- Dùng chất xúc tác MnO2
- Nung hỗn hợp kali clorat và mangan đioxit ở nhiệt độ cao
- Dùng phương pháp đẩy nước để thu khí oxi
- Dùng kali clorat và mangan đioxit khan
Hãy chọn các biện pháp đúng?
A. 2, 3, 4
B. 1, 2, 3
C. 1, 3, 4
D. 1, 2, 4
Câu 3: Để đánh giá mức độ xảy ra nhanh hay chậm của các phản ứng hóa học người ta dùng đại lượng nào dưới đây?
A. Thể tích khí
B. Tốc độ phản ứng
C. Nhiệt độ
D. Áp suất
Câu 4: Cho chất xúc tác MnO2 vào 100 ml dung dịch H2O2, sau 60 giây thu được 3,36 ml khí O2 (đktc). Tốc độ trung bình của phản ứng (tính theo H2O2) trong 60 giây trên là
A. 2,5.10−4 mol/(l.s)
B. 5,0.10−4 mol/(l.s)
C. 1,0.10−3 mol/(l.s)
D. 5,0.10−5 mol/(l.s)
Câu 5: Cho phương trình hóa học của phản ứng: X + 2Y → Z + T. Ở thời điểm ban đầu, nồng độ của chất X là 0,01 mol/l. Sau 20 giây, nồng độ của chất X là 0,008 mol/l. Tốc độ trung bình của phản ứng tính theo chất X trong khoảng thời gian trên là
A. 4,0.10−4 mol/(l.s)
B. 7,5.10−4 mol/(l.s)
C. 1,0.10−4 mol/(l.s)
D. 5,0.10−4 mol/(l.s)
Câu 6: Người ta thường sử dụng nhiệt của phản ứng đốt than đá để nung vôi. Biện pháp kĩ thuật nào sau đây không được sử dụng để làm tăng tốc độ phản ứng nung vôi?
A. Đập nhỏ đá vôi với kích thước khoảng 10cm
B. Tăng nồng độ khí cacbonic
C. Thổi không khí nén vào lò nung vôi
D. Tăng nhiệt độ phản ứng lên 900∘C
Câu 7: Đối với phản ứng có chất khí tham gia thì nhận định nào dưới đây là đúng?
A. Áp suất không ảnh hưởng đến tốc độ phản ứng
B. Khi áp suất tăng, tốc độ phản ứng giảm
C. Khi áp suất giảm, tốc độ phản ứng tăng
D. Khi áp suất tăng, tốc độ phản ứng tăng
Câu 8: Trong hệ dị thể, nếu tăng diện tích tiếp xúc giữa các chất phản ứng thì sẽ có kết quả nào sau đây?
A. Nhiệt độ của phản ứng tăng
B. Tốc độ của phản ứng giảm
C. Nhiệt độ của phản ứng giảm
D. Tốc độ của phản ứng tăng
Câu 9: Phát biểu nào sau đây đúng?
A. Khi đốt củi, nếu thêm một ít dầu hỏa, lửa sẽ cháy mạnh hơn. Như vậy dầu hỏa là chất xúc tác cho quá trình này.
B. Trong quá trình sản xuất rượu (ancol) từ gạo người ta rắc men lên gạo đã nấu chín (cơm) trước khi đem ủ vì en là chất xúc tác có tác dụng làm tăng tốc độ phản ứng chuyển hóa tinh bột thành rượu.
C. Một chất xúc tác có thể xúc tác cho tất cả các phản ứng.
D. Có thể dùng chất xúc tác để làm giảm tốc độ của phản ứng.
Câu 10: Khi đốt củi, để tăng tốc độ cháy, người ta sử dụng biện pháp nào sau đây?
A. Đốt trong lò kín.
B. Xếp củi chặt khít.
C. Thổi hơi nước.
D. Thổi không khí khô.
Câu 11: Chất xúc tác dương có tác dụng nào sau đây?
A. Làm chuyển dịch cân bằng của phản ứng theo chiều mong muốn
B. Làm phản ứng tỏa nhiệt
C. Tăng tốc độ phản ứng thuận và phản ứng nghịch
D. Tăng năng lượng hoạt hóa
Câu 12: Cho phản ứng thuận nghịch sau: N2 + 3H2 ⇌ 2NH3
Tốc độ phản ứng thay đổi như thế nào khi tăng dung tích bình phản ứng lên gấp hai lần (nhiệt độ không đổi)?
A. Giảm xuống 8 lần
B. Tăng lên 8 lần
C. Giảm xuống 16 lần
D. Tăng lên 16 lần
Câu 13: Biết rằng sau khi tăng nhiệt độ lên 10∘C thì tốc độ phản ứng tăng lên hai lần. Vậy khi tăng nhiệt độ từ 35∘C đến 95∘C thì tốc độ phản ứng tăng lên bao nhiêu lần?
A. 32
B. 48
C. 64
D. 72
Câu 14: Có hai cốc chứa dung dịch Na2SO3, trong đó cốc A có nồng độ lớn hơn cốc B. Thêm nhanh cùng một lượng dung dịch H2SO4 cùng nồng độ vào hai cốc. Hiện tượng quan sát được trong thí nghiệm trên là
A. cốc A xuất hiện kết tủa vàng nhạt, cốc B không thấy kết tủa.
B. cốc A xuất hiện kết tủa nhanh hơn cốc B.
C. cốc A xuất hiện kết tủa chậm hơn cốc B.
D. cốc A và cốc B xuất hiện kết tủa với tốc độ như nhau.
Câu 15: Từ thế kỉ XIX, người ta nhận thấy rằng trong thành phần của khí lò cao (lò luyện gang) còn chứa khí CO. Nguyên nhân của hiện tượng này là
A. Lò xây chưa đủ độ cao.
B. Thời gian tiếp xúc của CO và Fe3O4 chưa đủ.
C. Nhiệt độ chưa đủ cao.
D. Phản ứng giữa CO và oxit sắt là thuận nghịch.
Câu 16: Khi bắt đầu phản ứng, nồng độ của một chất là 0,6 mol/lit. Sau 20 giây xảy ra phản ứng, nồng độ của chất đó là 0,3 mol/lit. Tốc độ xảy ra phản ứng trong thời gian đó là:
A. 0,02 mol.1−. s−
B. 0,015 mol.1−. s−
C. 0,025 mol.1−. s−
D. 0,03mol.1−. s−
Câu 17: Để hầm (ninh) thịt cá cho nhanh mềm, người nội trợ dùng biện pháp nào sau đây?
A. Chặt nhỏ thịt, cá
B. Cho thêm muối vào
C. Dùng nồi áp xuất
D. Cả A, B, C đều đúng
Câu 18: Ở 160∘C, một phản ứng hóa học kết thúc sau 20p, nếu hạ nhiệt độ xuống 70∘C thì thời gian để kết thúc là bao nhiêu phút? Biết hệ số nhiệt của phản ứng trong khoảng nhiệt độ đó là 2.
A. 10240p
B. 9240p
C. 9660p
D. 11240p
Câu 19: Đối với phản ứng phân hủy H2O2 trong nước, khi thay đổi yếu tố nào sau đây, tốc độ phản ứng không thay đổi?
A. Thêm MnO2
B. Tăng nòng độ H2O2
C. Đun nóng
D. Tăng áp suất H2
Câu 20: Người ta sử dụng các biện pháp sau để tăng tốc độ phản ứng
1. Dùng khí nén, nóng thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang).
2. Nung đá vôi ở nhiệt độ cao để sản xuất vôi sống.
3. Nghiền nguyên liệu trước khi nung để sản xuất clanhke.
4. Cho bột sắt làm xúc tác trong quá trình sản xuất NH3 từ N2 và H2.
Trong các biện pháp trên, có bao nhiêu biện pháp đúng?
A. 1
B. 2
C. 3
D. 4
Câu 21: Cho phản ứng: H2 + S →t∘ H2S. Khi tăng nhiệt độ lên 15∘C thì tốc độ phản ứng tăng lên 3 lần. Vậy khi tăng nhiệt độ từ 25∘C đến 100∘C thì tốc độ phản ứng tăng lên bao nhiêu lần?
A. 15 lần
B. 240 lần
C. 125 lần
D. 243 lần
Câu 22: Nhận định nào dưới đây là đúng?
A. Nồng độ chất phản ứng tăng thì tốc độ phản ứng tăng
B. Sự thay đổi nồng độ chất phản ứng không ảnh hưởng đến tốc độ phản ứng
C. Nồng độ chất phản ứng giảm thì tốc độ phản ứng tăng
D. Nồng độ chất phản ứng tăng thì tốc độ phản ứng giảm
Câu 23: Ở 10∘C hai phản ứng xảy ra với cùng một tốc độ (v1= v2). Hệ số nhiệt độ của phản ứng thứ nhất và thứ hai là 2 và 3. Nếu ở phản ứng thứ nhất nhiệt độ tăng lên 50∘C và phản ứng thứ hai nhiệt độ tăng lên 30∘C thì tốc độ phản ứng trên có tỉ lệ như thế nào?
A. 16: 9
B. 1: 2
C. 20: 27
D. 6: 13
Câu 24: Hai nhóm học sinh làm thí nghiệm nghiên cứu tốc độ phản ứng kẽm với dung dịch axit clohiđric
• Nhóm thứ nhất: Cân 1 gam kẽm miếng và thả vào cốc đựng 200 ml dung dịch axit HCl 2M
• Nhóm thứ hai: Cân 1 gam kẽm bột và thả vào cốc đựng 300 ml dung dịch axit HCl 2M
Kết quả cho thấy bọt khí thoát ra ở thí nghiệm của nhóm thứ hai mạnh hơn là do:
A. Nhóm thứ hai dùng axit nhiều hơn.
B. Diện tích bề mặt kẽm bột lớn hơn kẽm miếng.
C. Nồng độ kẽm bột lớn hơn.
D. Cả ba nguyên nhân đều sai.
Câu 25: Thực nghiệm cho biết tốc độ phản ứng A2 + B2→ 2AB được tính theo biểu thức: v = k.[A2][B2].
Trong các điều khẳng định dưới đây, khẳng định nào phù hợp với biểu thức trên?
A. Tốc độ phản ứng hoá học được đo bằng sự biến đổi nồng độ các chất phản ứng trong một đơn vị thời gian.
B. Tốc độ phản ứng tỉ lệ thuận với tích số nồng độ các chất phản ứng.
C. Tốc độ phản ứng giảm theo tiến trình phản ứng.
D. Tốc độ phản ứng tăng lên khi có mặt chất xúc tác.
Đáp án
| 1D | 2D | 3B | 4B | 5C | 6B | 7D | 8D | 9B | 10D |
| 11C | 12C | 13C | 14B | 15B | 16B | 17D | 18A | 19D | 20D |
| 21D | 22A | 23A | 24B | 25B |
-----------------------------------------------
Trong phần chuyên đề trên đây chúng ta có thể hiểu biết thêm về Tốc độ phản ứng hóa học gồm các khái niệm, ý nghĩa thực tiễn, các yếu tổ ảnh hưởng đến tốc độ phản ứng hóa học.
Như vậy VnDoc đã giới thiệu các bạn tài liệu Lý thuyết Hóa học lớp 10 bài 36: Tốc độ phản ứng hóa học. Mời các bạn tham khảo thêm tài liệu: Trắc nghiệm Sinh học 10, Giải bài tập Sinh học lớp 10, Giải Vở BT Sinh Học 10, Giải bài tập Sinh học 10 ngắn nhất, Tài liệu học tập lớp 10.
Để tiện trao đổi, chia sẻ kinh nghiệm về giảng dạy và học tập các môn học lớp 10, VnDoc mời các thầy cô giáo, các bậc phụ huynh và các bạn học sinh truy cập nhóm riêng dành cho lớp 10 sau: Nhóm Tài liệu học tập lớp 10. Rất mong nhận được sự ủng hộ của các thầy cô và các bạn.








