Kim loại tác dụng với Halogen - Lý thuyết bài tập Hay
Chuyên đề Hóa học lớp 10: Kim loại tác dụng với Halogen được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Bài tập Halogen tác dụng với kim loại
A. Phương pháp ví dụ bài tập kim loại tác dụng với Halogen
1. Lý thuyết và phương pháp giải
Một số lưu ý:
Khi kim loại tác dụng với các chất oxi hóa mạnh như F2, Cl2, Br2 sẽ được oxi hóa lên hóa trị cao nhất.
Ví dụ:
2Fe + 3Cl2 → 2FeCl3;
Fe + 2HCl → FeCl2 + H2
2. Ví dụ minh họa
Ví dụ 1. Cho 5,25 gam hỗn hợp bột nhôm và magie vào dung dịch HCl dư, thu được 6,507375lít khí (đkc). Viết phản ứng xảy ra và tính phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu?
Hướng dẫn giải chi tiết
Gọi a là số mol của Al và b là số mol của Mg
Ta có: nH2 = 6,507375/24,79 = 0,625 (mol)
2Al + 6HCl → 2AlCl3 + 3H2
a 3a/2 (mol)
Mg + 2HCl → MgCl2 + H2
b b (mol)
Theo đề bài, ta có hệ phương trình:
 \(\left\{ \begin{array}{l}
27a + 24b = 5,25\\
\frac{{3a}}{2} + b = 0,2625
\end{array} \right.\)
\(\left\{ \begin{array}{l}
27a + 24b = 5,25\\
\frac{{3a}}{2} + b = 0,2625
\end{array} \right.\)
Giải hệ phương trình ta được a = 0,35/3; b = 0,0875
Vậy:
 \(\begin{array}{l}
\% {m_{Al}} = \frac{{\frac{{0,35}}{3}.27}}{{5,25}}.100\% = 60\% \\
\% {m_{Mg}} = \frac{{0,0875.24}}{{5,25}}.100\% = 40\%
\end{array}\)
\(\begin{array}{l}
\% {m_{Al}} = \frac{{\frac{{0,35}}{3}.27}}{{5,25}}.100\% = 60\% \\
\% {m_{Mg}} = \frac{{0,0875.24}}{{5,25}}.100\% = 40\%
\end{array}\)
Ví dụ 2: Cho 4,8 g một kim loại R thuộc nhóm IIA tác dụng hết với dung dịch HCl thu được 4,958 lít khí H2 (đkc).
a) Viết phương trình hóa học của phản ứng xảy ra và tính số mol hydrogen thu được.
b) Xác định tên kim loại R.
c) Tính khối lượng muối khan thu được
Hướng dẫn giải chi tiết
a, PTHH: R + 2HCl → RCl2 + H2
nH2 = 4,958/24,79 = 0,2 mol
b, nR = nH2 = 0,2 mol
MR = 4,8/0,2 = 24 (Mg)
c, mMgCl2 = (24 + 71) . 0,2 = 19g
Ví dụ 3: Để hoà tan hoàn toàn 8,1g một kim loại X thuộc nhóm IIIA cần dùng 450 ml dung dịch HCl 2M, thu được dung dịch A và V lít khí H2 (đkc).
a) Xác định X
b) Tính giá trị V.
c) Tính nồng độ mol của dung dịch A, xem như thể tích dung dịch thay đổi không đáng kể.
Hướng dẫn giải chi tiết
a, PTHH: 2X + 6HCl → 2XCl3 + 3H2
nHCl = 0,45 .2 =0,9 mol ⇒ nX = 0,9/3= 0,3 mol
MX = 8,1 /0,3 = 27 (Al)
b, nH2 = 1/2nHCl =0,45 mol
VH2 = 0,45 .22,4 = 10,08 l
c, Dung dịch A là AlCl3
nAlCl3 = nX = 0,3 mol
CM = n/V = 0,3/0,45 = 0,67M
Ví dụ 4. Chất A là muối canxi halogenua. Cho dung dịch chứa 0,2 gam A tác dụng với lượng dư dung dịch bạc nitrat thì thu được 0,376 gam kết tủa bạc halogenua. Hãy xác định công thức chất A.
Hướng dẫn giải chi tiết
Phương trình hóa học:
CaX2 + 2AgNO3 → Ca(NO3)2 + 2AgX (X là halogen)
Áp dụng pp tăng giảm khối lượng:
Theo phương trình cứ 1 mol CaX2 tham gia phản ứng tạo 2 mol AgX.
Khối lượng AgX tăng so với khối lượng CaX2 là:
(2.108 + 2MX) – (40 – 2MX) = 176
Theo đề bài, số mol CaX2 tham gia phản ứng là:
(0,376-0,2)/176 = 10-3 (mol)
→ MCaX2 = 0,2/10-3 = 200 → 40 + 2MX = 200 → MX = 80
Vậy X là Brom (Br). Công thức của chất A là CaBr2
Ví dụ 5. Cho 300ml một dung dịch có hòa tan 5,85 gam NaCl tác dụng với 200ml dung dịch có hòa tan 34 gam AgNO3, người ta thu được một kết tủa và nước lọc.
a) Tính khối lượng chất kết tủa thu được.
b) Tính nồng dộ mol chất còn lại trong nước lọc. Cho rằng thể tích nước lọc thu được không thể thay đổi đáng kể.
Hướng dẫn giải chi tiết
Ta có: nNaCl = 5,85/58,8 = 0,1(mol) và nAgNO3 = 34/170 = 0,2(mol)
a) Tính khối lượng kết tủa:
NaCl + AgNO3 → AgCl↓ + NaNO3
(mol) 0,1 → 0,1→ 0,1→ 0,1
Từ (1) ⇒ nAgCl = 0,1(mol) ⇒ mAgCl↓ = 0,1.143,5 = 14,35 (gam)
b) Ta có: Vdung dịch = 300 + 200= 500 (ml) = 0,5 (lít)
Từ (1) ⇒ Dung dịch thu được chứa: NaNO3 = 0,1(mol) và AgNO3 dư: 0,2-0,1 = 0,1(mol)
Vậy: CM(NaNO3) = CM(AgNO3)dư = 0,1/0,5 = 0,2M
B. Bài tập luyện tập có lời giải
Câu 1. Lấy một lượng kim loại M tác dụng với khí clo dư thu được 39 gam muối clorua. Cũng lượng kim loại đó tác dụng với dung dịch HCl dư, cô cạn dung dịch thu được 39,48 gam muối clorua khan. Hỏi kim loại M đem dùng là gì?
Đáp án hướng dẫn giải
Gọi α là số mol kim loại M tham gia trong mỗi thí nghiệm.
2M + aCl2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2MCla (1)
\(\overset{t^{\circ } }{\rightarrow}\) 2MCla (1)
α → α (mol)
2M + 2bHCl → 2MClb + bH2
α → α (mol)
 \(\left\{ \begin{array}{l}
\alpha (M + 35,5a) = 39\\
\alpha (M + 35,5b) = 20,48
\end{array} \right. = > 0,24M = 30,48 - 39b\)
\(\left\{ \begin{array}{l}
\alpha (M + 35,5a) = 39\\
\alpha (M + 35,5b) = 20,48
\end{array} \right. = > 0,24M = 30,48 - 39b\)Bảng biện luận
| a | 1 | 1 | 2 | 2 | 3 | 3 |
| b | 1 | 2 | 1 | 3 | 2 | 1 |
| M | < 0 | < 0 | 91,5 | < 0 | 56(Fe) | 218,5 |
| Loại | Loại | Loại | Loại | Nhận | Loại |
Câu 2. Cho 16,2 gam nhôm phản ứng vừa đủ với 90,6 gam hỗn hợp hau halogen thuộc hai chu kì liên tiếp nhau trong bảng tuần hoàn. Xác định tên của halogen đem dùng.
Đáp án hướng dẫn giải
Gọi công thức chung của hai halogen là: X−2 (gồm halogen A và B, giả sử MA < MB)
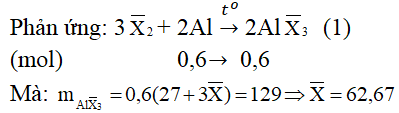
Suy ra: A là chlorine (35,5); B là bromine (80)
Câu 3. Cho 2, 8 gam kim loại M (chưa biết hóa trị) tác dụng với khí clo dư thu được 8,125 gam muối chloride.
a. Hãy xác định kim loại M
b. Để hòa tan hết 8,4 gam kim loại M ở trên cần dùng bao nhiêu ml dung dịch HCl 20% (d = 1,1 g/ml)?
Đáp án hướng dẫn giải
a) Phản ứng: 2M + nCl2→ 2MCla
2,8/M 0,075 mol
Áp dụng định luật bảo toàn khối lượng: mM + mCl2 = m muối
=> mCl2 = 8,125 - 2,8 = 5,325 (gam)
=> nCl2 = 5,325/71 = 0,075 (mol)
Theo phương trình: nM/nCl2 = 2/n = 2,8/0,075M => 0,15 = 2,8n/M => M/n = 56/3
+) Nếu n = 1 ⇒ M = 18,67 (loại)
+) Nếu n = 2 ⇒ M = 37,33 (loại)
+) Nếu n = 3 ⇒ M = 56 (Kim loại M là Fe)
b) Phản ứng: Fe + 2HCl → FeCl2 + H2
0,15 0,3 (,ol)
Ta có: nFe = 8,4/56 = 0,15 mol
=> nHCl = 0,3 (mol) => mHCl = 10,96 (gam)
=> mdung dịch HCl cần dùng = 10,95.100/20 = 54,75 gam
Vậy V dung dịch HCl = 54,75/1,1 = 49,77 (ml)
Câu 4. Đốt cháy 11,9 gam hỗn hợp gồm Zn, Al trong khí Cl2 dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 40,3 gam hỗn hợp muối. Thể tích khí Cl2 (ở đkc) đã phản ứng là bao nhiêu?
Đáp án hướng dẫn giải
Bảo toàn khối lượng mCl2 = mMuối − mKL = 28,4 gm
⇒ nCl2 = 0,4 mol ⇒ V = 9,916 (l)
Câu 5. Hỗn hợp khí A gồm chlorine và oxygen. A phản ứng vừa hết với một hỗn hợp gồm 4,8 gam magnesium và 8,1 gam nhôm tạo ra 37,05 gam hỗn hợp các muối chloride và oxide của hai kim loại. Xác định thành phần phần trăm theo khối lượng và theo thể tích của hỗn hợp A.
Đáp án hướng dẫn giải
Các phương trình hóa học:
Mg + Cl2 → MgCl2 (1)
2Al + 3Cl2 → AlCl3 (2)
3Mg + O2 → 2MgO (3)
4Al + 3O2 → 2AlO3 (4)
Khối lượng hỗn hợp sau phản ứng tăng = khối lượng oxygen và chlorine tham gia phản ứng:
37, 05 – (4,80 + 8,10) = 24, 15 (gam)
nMg = 4,8/24 = 0,2(mol); nAl = 8,1/27 = 0,3 (mol);
Gọi số mol O2 trong hỗn hợp là x, số mol Cl2 là y
Phương trình nhường e:
Al → Al3+ + 3e
Mg → Mg2+ + 2e
Tổng số mol e nhường là: 0,2 × 2 + 0,3 × 3 = 1,3 (mol)
Phương trình nhận e:
O2 + 4e → 2O2-
Cl2 + 2e → 2Cl-
Tổng số mol e nhận là: 4x + 2y
Số e nhường = số e nhận nên: 4x + 2y = 1,3 (*)
Khối lượng Cl2 và O2 tham gia phản ứng là 24, 15 gam, ta có:
32x + 71y = 24,15 (**)
Kết hợp (*) và (**), ta có hệ phương trình:
![]() \(\left\{ \begin{array}{l}
32x + 71y = 24,15\\
4x + 2y = 1,3
\end{array} \right.\)
\(\left\{ \begin{array}{l}
32x + 71y = 24,15\\
4x + 2y = 1,3
\end{array} \right.\)
Giải hệ phương trình, ta được: x = 0,2; y = 0,25
Phần trăm khối lượng:
 \(\begin{array}{l}
\% {m_{{O_2}}} = \frac{{32.0,2}}{{24,25}}.100\% = 26,5\% \\
\% {m_{C{l_2}}} = 100\% - 26,5\% = 73,5\%
\end{array}\)
\(\begin{array}{l}
\% {m_{{O_2}}} = \frac{{32.0,2}}{{24,25}}.100\% = 26,5\% \\
\% {m_{C{l_2}}} = 100\% - 26,5\% = 73,5\%
\end{array}\)
Phần trăm theo thể tích
 \(\begin{array}{l}
\% {V_{{O_2}}} = \frac{{0,2}}{{0,45}}.100\% = 44,44\% \\
\% {V_{C{l_2}}} = 100\% - 44,44\% = 55,56\%
\end{array}\)
\(\begin{array}{l}
\% {V_{{O_2}}} = \frac{{0,2}}{{0,45}}.100\% = 44,44\% \\
\% {V_{C{l_2}}} = 100\% - 44,44\% = 55,56\%
\end{array}\)Câu 6. Hòa tan 8,3 gam hỗn hợp gồm Al và Fe bằng dung dịch HCl dư, thu được 6,1975 lít H2 (đkc) và dung dịch A.
a. Tính phần trăm theo khối lượng mỗi muối trong hỗn hợp ban đầu.
b. Tính thể tích dung dịch HCl 2M đã dùng biết đã dùng dư 10cm3 so với lí thuyết.
c. Dẫn khí Cl2 dư vào dung dịch A. Cô cạn dung dịch sau phản ứng thì thu được bao nhiêu gam muối khan.
Đáp án hướng dẫn giải
a)Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu:
Ta có: nH2 = 6,1975/24,79 = 0,25 (mol)
Gọi a là số mol của Al và b là số mol của Fe
Phản ứng:
2Al + 6HCl → 2AlCl3 + 3H2 ↑ (1)
(mol) a → 3a 3a/2
Fe + 2HCl → FeCl2 + H2 ↑ (2)
(mol) b → 2b b
Gọi a là số mol của Al và b là số mol của Fe.
Theo đề bài, ta có hệ phương trình:
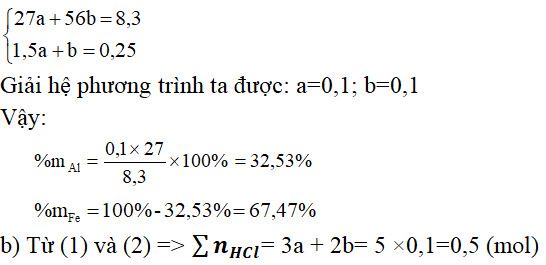
VHCl phản ứng = 0,5/2 = 0,25 (lít) = 250(ml)
Vậy VHCl đã dùng = 250 + 10 = 260 (ml)
c) Khối lượng muối khan:
Cl2 + AlCl3 → không phản ứng
Cl2 + 2FeCl2 → 2FeCl3
(mol) 0,1 → 0,1
Khối lượng muối khan thu được là:
mmuối khan = mAlCl3 + mFeCl3 = 0,1 ×(133,5 + 162,5) = 29,6 (gam)
C. Bài tập tự luyện
Bài 1: Cho một lượng halogen tác dụng hết với magiê thu được 19g magiê halogenua. Cũng lượng halogen đó tác dụng hết với nhôm tạo ra 17,8g nhôm halogenua. Hãy xác địng tên và khối lượng của halogen nói trên.
Bài 2: Cho 6,48g kim loại M tác dụng với khí clo tạo thành 25,65g clorua kim loại. Xác định tên kim loại M.
Bài 3: Cho 2,06g muối natri halogenua (A) tác dụng với dung dịch AgNO3 đủ thu được kết tủa (B). Kết tủa này sau khi phản ứng phân hủy hoàn toàn cho 2,61g Ag. Xác định muối A .
Bài 4: Hòa tan hết một kim loại hóa trị II vào lượng dung dịch HCl 14,6% vừa đủ được một dung dịch muối có nồng độ 18,19%. Xác định kim loại trên.
Bài 5: Hòa tan 8,3g hỗn hợp (Al, Fe) trong HCl dư thu được 6,1975 lít H2 (đkc) và dung dịch A.
a. Tính khối lượng mỗi kim loại trong hỗn hợp đầu.
b. Tính thể tích dung dịch HCl 2M đã dùng, biết đã dùng dư 10cm3 so với lí thuyết.
c. Dẫn một luồng khí Cl2 vào dung dịch A để phản ứng xảy ra hoàn toàn. Cô cạn dung dịch sau phản ứng thì được bao nhiêu gam muối khan ?
Bài 6: Có 5 bình mỗi bình chứa một trong các chất khí: chlorine, hydrogen, nitrogen, oxygen, Khí Carbon dioxide. Không dùng đến phản ứng hóa học, làm thế nào nhận ra bình chứa chlorine trong trường hợp :
a. Các bình đều được làm bằng thủy tinh không màu.
b. Các bình đều được làm bằng thủy tinh sẫm màu.









