Hóa học 10 bài 17: Phản ứng oxi hóa khử
Chuyên đề Hóa học lớp 10: Phản ứng oxi hóa khử được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Lý thuyết: Phản ứng oxi hóa khử
A/ Lý thuyết Hóa học 10 bài 17
I. Phản ứng oxi hóa - khử
Phản ứng oxi hóa khử là phản ứng hóa học, trong đó có sự chuyển electron giữa các chất trong phản ứng hay phản ứng oxi hóa khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa của một số nguyên tố.
- Chất khử (chất bị oxh) là chất nhường electron
- Chất oxh (chất bị khử) là chất thu electron.
- Quá trình oxh (sự oxh) là quá trình nhường electron.
- Quá trình khử (sự khử) là quá trình thu electron.
Ví dụ:
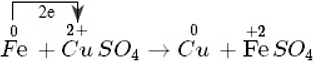
Quá trình thay đổi số oxi hóa:
Fe0 → Fe2+ + 2e
- Số oxi hóa của sắt tăng từ 0 đến +2. Nguyên tử sắt là chất khử. Sự làm tăng số oxi hóa của sắt được gọi là sự oxi hóa nguyên tử sắt.
- Nguyên tử sắt nhường electron, là chất khử. Sự nhường electron của nguyên tử sắt được gọi là sự oxi hóa nguyên tử sắt.
Cu2+ + 2e → Cu
- Số oxi hóa của đồng giảm từ +2 xuống 0. Ion đồng là chất oxi hóa. Sự làm giảm số oxi hóa của ion đồng được gọi là sự khử ion đồng.
- Ion đồng nhận electron, là chất oxi hóa. Sự nhận electron của ion đồng được gọi là sự khử ion đồng.
⇒ Phản ứng của sắt với dung dịch đồng sunfat cũng là phản ứng oxi hóa - khử vì tồn tại đồng thời sự oxi hóa và sự khử.
II. Lập phương trình hóa học của phản ứng oxi hóa khử
Bước 1: Xác định số oxh của các nguyên tố để tìm chất oxi hoá và chất khử.
Bước 2: Viết quá trình oxh và quá trình khử, cân bằng mỗi quá trình.
Bước 3: Tìm hệ số thích hợp cho chất oxh và chất khử sao cho tổng số electron cho bằng tổng số electron nhận.
Bước 4: Đặt hệ số của các chất oxh và khử vào sơ đồ phản ứng, từ đó tính ra hệ số các chất khác. Kiểm tra cân bằng số nguyên tử của các nguyên tố và cân bằng điện tích hai vế để hoàn thành PTHH.
Ví dụ: Lập PTHH của phản ứng oxi hoá khử sau:
NH3 + Cl2 → N2 + HCl
Bước 1:

Số oxh của N tăng từ -3 lên 0: Chất khử.
Số oxh của Cl giảm từ 0 xuống -1: Chất oxh.
Bước 2:
Quá trình oxi hóa:
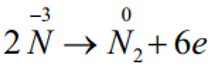
Quá trình khử:
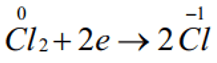
Bước 3:
Quá trình oxi hóa:
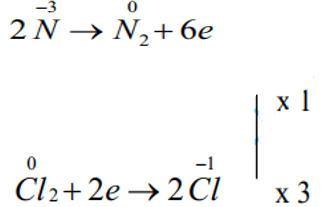
Bước 4: Viết PTHH
2NH3 + 3Cl2 → N2 + 6HCl
III. Ý nghĩa của phản ứng oxi hóa – khử
- Phản ứng oxi hóa - khử là một trong những quá trình quan trọng nhất của thiên nhiên:
Sự hô hấp, quá trình thực vật hấp thụ khí cacbonic giải phóng oxi, sự trao đổi chất và hàng loạt quá trình sinh học khác đều có cơ sở là các phản ứng oxi hóa - khử.
- Ngoài ra: Sự đốt cháy nhiên liệu trong các động cơ, các quá trình điện phân, các phản ứng xảy ra trong pin và trong ăcquy đều bao gồm sự oxi hóa và sự khử.
Hàng loạt quá trình sản xuất như luyện kim, chế tạo hóa chất, chất dẻo, dược phẩm, phân bón hóa học, ... đều không thực hiện được nếu thiếu các phản ứng oxi hóa - khử.
B/ Trắc nghiệm Hóa học 10 bài 17
Câu 1: Phát biểu nào dưới đây không đúng?
A. Sự oxi hóa là sự mất electron
B. Sự khử là sự mất electron hay cho electron
C. Chất khử là chất nhường electron
D. Chất oxi hóa là chất thu electron
Câu 2: Cho các quá trình sau:
1. Đốt cháy than trong không khí
2. Làm bay hơi nước biển trong quá trình sản xuất muối biển
3. Nung vôi
4. Tôi vôi
5. Iot thăng hoa
Trong các quá trình trên, quá trình nào có phản ứng hóa học xảy ra?
A. 2,3,4,5
B. 1, 2, 3
C. 1, 3, 4
D. Tất cả các quá trình trên
Câu 3: Trong phản ứng đốt cháy CuFeS2 để tạo thành sản phẩm CuO, Fe2O3 và SO2 thì CuFeS2 sẽ:
A. Nhường 26 (e)
B. Nhận 12 (e)
C. Nhận 13 (e)
D. Nhường 13 (e)
Câu 4: Trong các phản ứng oxi hóa khử, vai trò của Fe2+ là:
A. chỉ thể hiện tính khử
B. không có vai trò gì
C. chỉ thể hiện tính oxi hóa
D. thể hiện tính oxi hóa hoặc thể hiện tính khử
Câu 5: Cho phản ứng: Ca +Cl2 → CaCl2.
Kết luận nào sau đây đúng?
A. Mỗi nguyên tử Ca nhận 2e.
B. Mỗi nguyên tử Cl nhận 2e.
C. Mỗi phân tử Cl2 nhường 2e.
D. Mỗi nguyên tử Ca nhường 2e.
Câu 6: Phản ứng nào sau đây là phản ứng oxi hóa – khử?
A. NH3 + HCl → NH4Cl
B. H2S + 2NaOH → Na2S + 2H2O
C. 4NH3 + 3O2 → 2N2 + 6H2O
D. H2SO4 + BaCl2 → BaSO4 ↓ + 2HCl
Câu 7: Trong phản ứng: CaCO3 → CaO + CO2, nguyên tố cacbon
A. Chỉ bị oxi hóa.
B. Chỉ bị khử.
C. Vừa bị oxi hóa, vừa bị khử.
D. Không bị oxi hóa, cũng không bị khử.
Câu 8: Trong phản ứng: NO2 + H2O → HNO3 + NO, nguyên tố nitơ
A. Chỉ bị oxi hóa.
B. Chỉ bị khử.
C. Vừa bị oxi hóa, vừa bị khử.
D. Không bị oxi hóa, cũng không bị khử.
Câu 9: Trong phản ứng: Cu + 2H2SO4 (đặc, nóng) → CuSO4 + SO2 + 2H2O, axit sunfuric
A. Là chất oxi hóa.
B. Vừa là chất oxi hóa, vừa là chất tạo môi trường.
C. Là chất khử.
D. Vừa là chất khử, vừa là chất tạo môi trường.
Câu 10: Chất nào sau đây trong các phản ứng chỉ đóng vai trò là chất oxi hóa?
A. S
B. F2
C. Cl2
D. N2
Câu 11: Trong các phản ứng hóa học, SO2 có thể là chất oxi hóa hoặc chất khử vì
A. SO2 là oxit của đa axit
B. SO2 là oxit axit
C. Lưu huỳnh trong SO2 đã đạt số oxi hóa cao nhất
D. Lưu huỳnh trong SO2 có số oxi hóa trung gian
Câu 12: Khi cho Cl2 tác dụng với dung dịch NaOH ở nhiệt độ thường, trong phản ứng này Cl2 đóng vai trò là:
A. Vừa là chất khử vừa là chất oxi hóa
B. Chất nhận (e)
C. Chất nhường (e)
D. Chất nhường (p)
Câu 13: Cho các mệnh đề sau:
Lưu huỳnh chỉ thể hiện tính khử
S2− trong hidro sunfua chỉ thể hiện tính khử
SO2 vừa thể hiện tính khử, vừa thể hiện tính oxi hóa
Trong phân tử H2SO4 thì nguyên tố S chỉ thể hiện tính oxi hóa
Số mệnh đề phát biểu đúng là
A. 1
B. 3
C. 2
D. 4
Câu 14: Lượng cồn (C2H5OH) trong máu người được xác định bằng cách chuẩn độ huyết thanh với dung dịch kali đicromat. Sơ đồ phản ứng như sau
![]()
Hoàn thành phương trình trên thì hệ số của các chất sau khi cân bằng là:
A. 1, 3, 8, 2, 2, 2, 10
B. 1, 2, 8, 2, 2, 2, 11
C. 2, 3, 8, 2, 2, 2, 11
D. 1, 2, 8, 3, 2, 2, 11
Câu 15: Chất nào sau đây trong các phản ứng chỉ đóng vai trò là chấ khử?
A. cacbon
B. kali
C. hidro
D. hidro sunfua
Câu 16: Cho phương trình ion thu gọn: Cu + 2Ag+ → Cu2+ + 2Ag.
Kết luận nào sau đây sai?
A. Cu2+ có tính oxi hóa mạnh hơn Ag+.
B. Cu có tính khử mạnh hơn Ag.
C. Ag+ có tính oxi hóa mạnh hơn Cu2+.
D. Cu bị oxi hóa bởi ion Ag+.
Câu 17: Trong phản ứng nào sau đây, HCl đóng vai trò là chất oxi hóa?
A. Fe + KNO3 + 4HCl → FeCl3+ KCl + NO + 2H2O
B. MnO2 + 4HCl → MnCl2 + Cl2+ 2H2O
C. Fe + 2HCl → FeCl2 + H2
D. NaOH + HCl → NaCl + H2O
Câu 18: Cho phản ứng hóa học sau: FeS2 + O2 → Fe2O3 + SO2
Khi cân bằng phương trình phản ứng với hệ số các chất là các số nguyên tối giản, hệ số của O2 là
A. 4
B. 6
C. 9
D. 11
Câu 19: Phản ứng giữa HNO3 với FeO tạo khí NO. Tổng hệ số các chất sản phẩm trong phương trình hóa học của phản ứng này (số nguyên, tối giản) là
A. 8
B. 9
C. 12
D. 13
Câu 20: Cho phản ứng: Cu + HNO3 → Cu(NO3)2 + NO + H2O.
Sau khi cân bằng phương trình hóa học của phản ứng, tỉ lệ các hệ số của HNO3 và NO là
A. 4
B. 3
C. 2
D. 1
Câu 21: Nhận xét không đúng trong các nhận xét sau là
A. Trong phản ứng oxi hóa khử, sự oxi hóa và sự khử luôn diễn ra đồng thời
B. Nguyên tố ở mức oxi hóa trung gian, vừa có tính oxi hóa vừa có tính khử
C. Chất oxi hóa gặp chất khử đều có phản ứng hóa học xảy ra
D. Sự oxi hóa là quá trình nhường electron, sự khử là quá trình nhận electron
Câu 22: Cho 11,36 gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng dư, thu được 1,344 lít khí NO (sản phẩm khử duy nhất, đktc) và dung dịch X. Cô cạn X được m gam muối khan. Giá trị của m là:
A. 49,09
B. 34,36
C. 35,5
D. 38,72
Câu 23: Phát biểu nào sau đây đúng?
Đồng kim loại (Cu) có thể tác dụng với:
A. Dung dịch muối sắt (II) tạo thành muối đồng (II) và giải phóng sắt kim loại
B. Dung dịch muối sắt (III) tạo thành muối đồng (II) và muối sắt (II)
C. Dung dịch muối sắt (III) tạo thành muối đồng (II) và giải phóng sắt kim loại
D. Không thể tác dụng với muối sắt (III)
Câu 24: Dãy nào sau đây gồm các phân tử và ion đều vừa có tính khử vừa có tính oxi hóa?
A. HCl, Fe2+, Cl2
B. SO2, H2S, F−
C. SO2, S2−, H2S
D.Na2SO3, Br2, Al3+
Câu 25: Khối lượng K2Cr2O7 cần dùng để oxi hóa hết 0,6 mol FeSO4 trong môi trường H2SO4 loãng dư là
A. 14,7 gam
B. 9,8 gam
C. 58,8 gam
D. 29,4 gam
Đáp án
| 1B | 2C | 3D | 4D | 5D | 6C | 7D | 8C | 9B | 10B |
| 11D | 12A | 13B | 14B | 15B | 16A | 17C | 18D | 19B | 20A |
| 21C | 22D | 23B | 24A | 25D |
------------------------------------------
Trong phần chuyên đề trên đây chúng ta có thể hiểu biết thêm về Phản ứng oxi hóa khử gồm các khái niệm về phản ứng oxi hóa khử, các loại phản ứng thường gặp....
Như vậy VnDoc đã giới thiệu các bạn tài liệu Lý thuyết Hóa học lớp 10 bài 17: Phản ứng oxi hóa khử. Mời các bạn tham khảo thêm tài liệu: Trắc nghiệm Sinh học 10, Giải bài tập Sinh học lớp 10, Giải Vở BT Sinh Học 10, Giải bài tập Sinh học 10 ngắn nhất, Tài liệu học tập lớp 10.
Để tiện trao đổi, chia sẻ kinh nghiệm về giảng dạy và học tập các môn học lớp 10, VnDoc mời các thầy cô giáo, các bậc phụ huynh và các bạn học sinh truy cập nhóm riêng dành cho lớp 10 sau: Nhóm Tài liệu học tập lớp 10. Rất mong nhận được sự ủng hộ của các thầy cô và các bạn.








