Trắc nghiệm chương 1: Nguyên tử phần 7
Chuyên đề Hóa học lớp 10: Trắc nghiệm chương 1: Nguyên tử phần 7 được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Bài tập trắc nghiệm chương 1
Bài 1: Cấu hình electron của 4 nguyên tố:
9X: 1s22s22p5
11Y: 1s22s22p63s1
13Z: 1s22s22p63s23p1
8T: 1s22s22p4
Ion của 4 nguyên tố trên là:
A. X+, Y+, Z+, T2+.
B. X-, Y+, Z3+, T2-.
C. X-, Y2-, Z3+, T+.
D. X+, Y2+, Z+, T-
Chọn đáp án: B
Giải thích:
X có xu hướng nhận 1e → X-
Y có xu hướng nhương 1 e → Y+
Z có xu hướng nhường 3e → Z3+
T có xu hướng nhận 2 e → T2-
Bài 2: Một nguyên tử X của một nguyên tố có điện tích của hạt nhân là 27,2.10-19 Culông. Cho các nhận định sau về X:
(1) Ion tương ứng của X sẽ có cấu hình electron là: 1s22s22p63s23p6.
(2) X có tổng số obitan chứa electron là: 10.
(3) X có 1 electron độc thân.
(4) X là một kim loại.
Có bao nhiêu nhận định không đúng trong các nhận định cho ở trên?
A. 1 B. 2 C. 3 D. 4
Chọn đáp án: B.
Giải thích:
Nhận định không đúng: 2,4
Số hạt proton có điện tích bằng = +1,602.10-19
Số hạt proton trong X bằng: 27,2.10-19 : 1,602.10-19 = 17.
Cấu hình X là 1s22s22p63s23p5
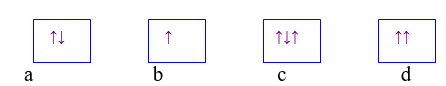
Bài 3: Hình vẽ nào sau đây vi phạm nguyên lí Pauli khi điền electron vào AO?
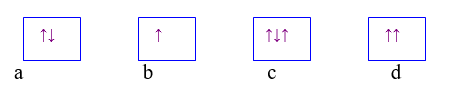
A. a.
B. b.
C. a và b.
D. c và d.
Chọn đáp án: D.
Giải thích: Theo nguyên lý Pau-li: trên 1 obitan có thể có nhiều nhất là 2 lectron và 2 electron này có chiều quay ngược nhau.
Bài 4: Cấu hình nào sau đây vi phạm nguyên lí Pauli:
A. 1s2.
B. 1s22s22p3.
C. 1s22s22p63s3.
D. 1s22s22p4.
Chọn đáp án: C.
Giải thích: Số electron tối đa trên phân lớp s chỉ có tối đa 2 e
Bài 5: Nguyên tử Al có bán kính 1,43 Ao và có nguyên tử khối là 27u. Khối lượng riêng của Al bằng bao nhiêu, biết rằng trong tinh thể nhôm các nguyên tử chỉ chiếm 74% thể tích, còn lại là các khe trống?
A. 1,96 B. 2,7 C. 3,64 D. 1,99
Chọn đáp án: B.
Giải thích:
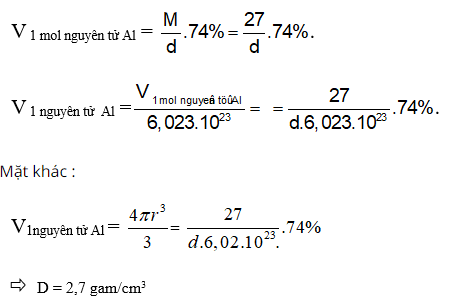
Bài 6: Trong nguyên tử X, giữa bán kính hạt nhân (r) và số khối của hạt nhân (A) có mối quan hệ như sau: r = 1,5.10-13.A1/3 cm. Tính khối lượng riêng (tấn/cm3) của hạt nhân nguyên tử X.
A. 1,175.1014
B. 1,5. 1013
C. 1,175.108
D. 3,5.1013
Chọn đáp án:
Giải thích:
Coi hạt nhân nguyên tử có dạng hình cầu, thì giữa thể tích hạt nhân và bán kính hạt nhân có mối liên hệ như sau:![]()
Thay r = 1,5.10-13.A1/3 cm vào (1) ta có:![]()
Trong nguyên tử, khối lượng của electron rất nhỏ nên khối lượng nguyên tử chủ yếu tập trung ở hạt nhân. Do đó khối lượng (gam) của 1 mol nguyên tử (M) có giá trị xấp xỉ bằng số khối (A).
Khối lượng của 1 nguyên tử xấp xỉ bằng khối lượng của hạt nhân =
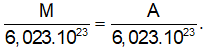
Khối lượng riêng của hạt nhân
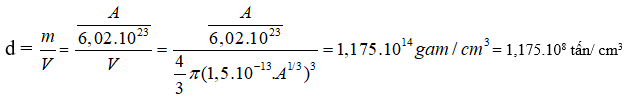
Bài 7: Một hợp chất có công thức XY2 trong đó X chiếm 50% về khối lượng. Trong hạt nhân của X và Y đều có số proton bằng số nơtron. Tổng số proton trong phân tử XY2 là 32. Viết cấu hình electron của X.
A. 1s22s22p63s23p4
B. 1s22s22p4
C. 1s22s22p63s2
D. 1s22s22p63s23p2
Chọn đáp án: A.
Giải thích:
Gọi số hạt proton, nơtron, electron của nguyên tử X là p, n, e và của Y là p’, n’, e’.
Theo bài: p = n = e và p’ = n’ = e’.
Trong hợp chất XY2, X chiếm 50% về khối lượng nên:
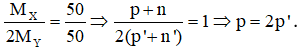
Tổng số proton trong phân tử XY2 là 32 nên p + 2p’ = 32.
Từ đây tìm được: p = 16 (S) và p’ = 8 (O). Hợp chất cần tìm là SO2.
Cấu hình electron của S: 1s22s22p63s23p4
Bài 8: Một loại khí X có chứa 2 đồng vị![]() Cho X2 tác dụng với H2 rồi lấy sản phẩm hoà tan vào nước thu được dung dịch Y. Chia dung dịch Y thành hai phần bằng nhau :
Cho X2 tác dụng với H2 rồi lấy sản phẩm hoà tan vào nước thu được dung dịch Y. Chia dung dịch Y thành hai phần bằng nhau :
- Phần thứ nhất cho tác dụng vừa đủ với 125 ml dung dịch Ba(OH)2 0,88M.
- Phần thứ hai cho tác dụng với AgNO3 vừa đủ ta thu được 31,57 gam kết tủa.
Thành phần % số nguyên tử của mỗi đồng vị là bao nhiêu?
A. 35 và 65
B. 40 và 60
C. 85 và 15
D. 75 và 25
Chọn đáp án: D
Giải thích:
Gọi phần trăm số nguyên tử của 3517X là x,3717X là (100 – x).
X2 + H2 → 2HX (1)
Thí nghiệm 1: nBa(OH)2 = 0,88.0,125 = 0,11 mol.
2HX + Ba(OH)2 → BaX2 + 2H2O (2)
mol: 0,22 ← 0,11
Thí nghiệm 2:
HX + AgNO3 → AgX ↓ + HNO3 (3)
mol: 0,22 → 0,22
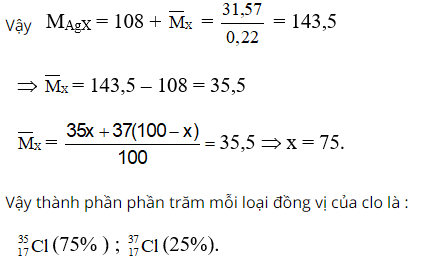
Bài 9: Trong nguyên tử cacbon, hai electron ở phân lớp p được phân bố trên 2 obitan p khác nhau và được biểu diễn bằng hai mũi tên cùng chiều. Nguyên lí hay quy tắc được áp dụng ở đây là :
A. Nguyên lí Pauli.
B. Quy tắc Hun.
C. Quy tắc Kleskopski.
D. Cả A, B và C.
Chọn đáp án: B
Bài 10: Nguyên tử M có cấu hình electron 1s2222p4. Phân bố electron trên các obitan là :
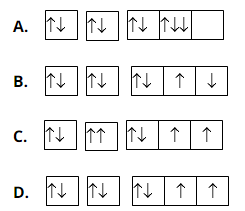
Chọn đáp án: D
Bài 11: Một hợp chất có công thức là MAx, trong đó M chiếm 46,67% về khối lượng. M là kim loại, A là phi kim ở chu kì 3. Trong hạt nhân của M có n - p = 4, trong hạt nhân của A có n’ = p’. Tổng số proton trong MAx là 58. Xác định công thức của MAx.
A. CO2 B. CaCl2 C. SiO2 D. FeS2
Chọn đáp án: D
Giải thích:
Trong hợp chất MAx, M chiếm 46,67% về khối lượng nên :
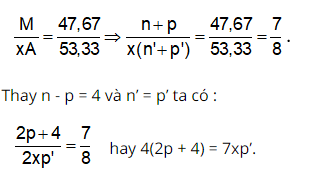
Tổng số proton trong MAx là 58 nên: p + xp’ = 58. Từ đây tìm được: p = 26 và xp’ = 32.
Do A là phi kim ở chu kì 3 nên 15 ≤ p’ ≤ 17. Vậy x = 2 và p’ = 16 thỏa mãn.
Vậy M là Fe và A là S; công thức của MAx là FeS2.
Sử dụng dữ kiện sau. Trả lời cho câu hỏi số 82, 83
Tổng số hạt cơ bản trong phân tử X có công thức là M2O là 140, trong phân tử X thì tổng số hạt mang điện nhiều hơn số hạt không mang điện là 44.
Bài 12: X là
A. Na2O B. Li2O C. Cu2O D. K2O
Chọn đáp án: D.
Bài 13: Số electron độc thân trong nguyên tử oxi là:
A. 1 B. 2 C. 3 D. 6
Chọn đáp án: B.
Giải thích:
Trong X có 2 nguyên tử M và 1 nguyên tử O.
Nên ta có: 2.ZM + 8 = (140 + 44) : 4 = 46 => Z =19 => K => X là K2O
Cấu hình electron và sự phân bố electron trong obitan của nguyên tử O là:
Bài 14: Tổng số hạt proton, nơtron, electron trong nguyên tử X là 28, trong đó số hạt không mang điện chiếm xấp xỉ 35% tổng số hạt. Số khối của X là?
A. 18 B. 19 C. 20 D. 21
Chọn đáp án: B.
Giải thích:
Trong nguyên tử của nguyên tố X có:
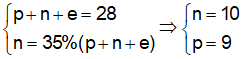
⇒ Vậy trong nguyên tử X, số p = số e = 9; số n = 10.
Bài 15: Một hợp chất có công thức XY2 trong đó X chiếm 50% về khối lượng. Trong hạt nhân của X và Y đều có số proton bằng số nơtron. Tổng số proton trong phân tử XY2 là 32. Cấu hình electron phù hợp với X và Y là:
A. X: 1s22s22p63s23p4, Y: 1s22s22p4
B. X: 1s22s22p63s2, Y: 1s22s22p4
C. X: 1s22s22p63s23p4, Y: 1s22s22p2
D. X: 1s22s22p63s23p2, Y: 1s22s22p6
Chọn đáp án: A.
Giải thích:
Gọi số hạt proton, nơtron, electron của nguyên tử X là p, n, e và của Y là p’, n’, e’.
Theo bài: p = n = e và p’ = n’ = e’.
Trong hợp chất XY2, X chiếm 50% về khối lượng nên:
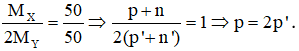
Tổng số proton trong phân tử XY2 là 32 nên p + 2p’ = 32.
Từ đây tìm được: p = 16 (S) và p’ = 8 (O). Hợp chất cần tìm là SO2.
Cấu hình electron của S: 1s22s22p63s23p4 và của O: 1s22s22p4.
Bài 16: Một nguyên tử có tống số hạt là 46. Trong đó tỉ số hạt mang điện tích đối với hạt không mang điện là 1,875. Khối lượng tuyệt đối của nguyên tử đó là
(Cho biết me = 9,109.10-31 kg ; mp = l,6726.10-27 kg; mn = 1,6748.10-27 kg).
A. 5,1673.10-26kg
B. 5,1899.10-26 kg.
C. 5,2131.10-26 kg
D. 5,1886.10-26 kg.
Chọn đáp án: B.
Giải thích:
Tổng số hạt bằng bằng 46
p + e + n = 46 hay 2p + n = 46 (do p = e) (1)
Tỉ số hạt mang điện (p và e) so với hạt không mang điện (n) là 1,875
p + e = 1,875n hay 2p -1,875n = 0 (2)
Giải (1), (2) ta có p = e = 15 hạt, n = 16 hạt.
Khối lượng nguyên tử tuyệt đối:
m = mp + mn = 15. l,6726.10-27 + 16. 1,6748.10-27 = 5,1899.10-26 kg.
Bài 17: Khối lượng riêng của canxi kim loại là 1,55 g/cm3. Giả thiết rằng trong tinh thể canxi các nguyên tử là những hình cầu chiếm 74% thể tích tinh thể, phần còn lại là khe rỗng. Bán kính nguyên tử canxi tính theo lý thuyết là:
A. 0,196 nm. B. 0,185 nm. C. 0,168 nm. D. 0,155 nm.
Chọn đáp án: A.
Giải thích:
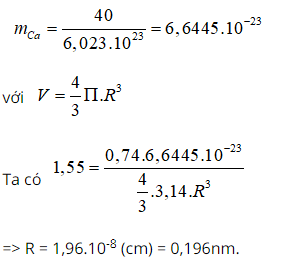
Bài 18: Một hợp chất được tạo thành từ các ion M+ và X22-. Trong phân tử của M2X2 có tổng số hạt proton, nơtron và electron là 164. Trong đó số hạt mang điện nhiều hơn hạt không mang điện là 52. Số khối của M lớn hơn số khối của X là 23 đơn vị. Tổng số hạt electron trong M+ nhiều hơn trong X22- là 7 hạt. Xác định các nguyên tố M, X
A. H2O2 B. Na2O2 C. K2O2 D. Li2O2
Chọn đáp án: C.
Giải thích:
Gọi p, e, n là số proton, số electron và số nơtron trong một nguyên tử M; p’, e’, n’ là số proton, số electron và số nơtron trong một nguyên tử X.
Trong nguyên tử số proton = số electron; các hạt mang điện là proton và electron, hạt không mang điện là nơtron.
+ Trong phân tử của M2X2 có tổng số hạt proton, nơtron và electron là 164 nên suy ra :
2(2p + n) + 2(2p’ + n’) = 164 (1)
+ Trong đó số hạt mang điện nhiều hơn hạt không mang điện là 52 nên suy ra :
(4p + 4p’) - 2(n + n’) = 52 (2)
+ Số khối của M lớn hơn số khối của X là 23 đơn vị nên ta có suy ra :
(p + n) - (p’ + n’) = 23 (3)
+ Tổng số hạt electron trong M+ nhiều hơn trong X22- là 7 hạt nên suy ra :
(2p + n - 1) - 2(2p’ + n’) + 2 = 7 (4)
Giải hệ (1), (2), (3), (4) ta được p = 19 ⇒ M là kali; p’ = 8 ⇒ X là oxi.
Công thức phân tử của hợp chất là K2O2.
Bài 19: Sự phân bố electron theo ô lượng tử nào dưới đây là đúng?
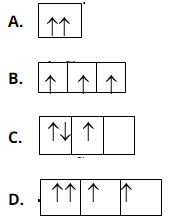
Chọn đáp án: C.
Giải thích: Theo nguyên lý Pauli, mỗi ô lượng tử chứa tối đa hai electron và hai electron này phải quay ngược chiều nhau.
Sử dụng dữ liệu sau, trả lời cho câu hỏi 90, 91
Có 3 đồng vị của nguyên tố X, mà tỏng số hạt trong 3 nguyên tử đồng vị là 75. Trong đồng vị 1, số p bằng số n, đồng vị 2 có số n kém thua đồng vị 3 là 1.
Bài 20: Số khối của mỗi đồng vị là:
A. 21,22,23
B. 22,23,24
C. 24,25,26
D. 25,26,27
Chọn đáp án: C
Bài 21: Trong X, số nguyên tử của các đồng vị thứ nhất, 2, 3 lần lượt theo tỉ lệ 115:3:2. Khối lượng mol trung bình của X là?
A. 24,333 B. 24,0583 C. 24,12 D. 24,00
Chọn đáp án: B
Giải thích:
Do là đồng vị nên các nguyên tử có cùng số proton =>
p + n1 + p + n2 + p + n3 = 75 ⇔ 3p + n1 + n2 + n3 =75 (1)
mà nguyên tử đồng vị 1 có p = n
=> (1) <=> 4p + n2 + n3 = 75 (2)
ta lại có n3 - n2 = 1
=> (2) <=> 4p + 2 n2 = 74 ⇔ 2p + n2 = 37
p ≤ 12,33 và p ≥ 10.5
p = 12 => n2 = 13 Vậy số khối 3 đồng vị lần lượt là 24, 25, 26
A = 24 . 115 + 25. 3 + 26.2 / ( 115 + 3 +2 ) = 24,0583
Bài 22: Trong nguyên tử một nguyên tố X có 29 electron và 36 nơtron. Số khối và số lớp electron của nguyên tử X lần lượt là:
A. 65 và 4.
B. 64 và 4.
C. 65 và 3.
D. 64 và 3.
Chọn đáp án: A
Giải thích:
Số khối = p + n = 29 + 36 = 65
Cấu hình e của X: 1s22s22p63s23p63d104s1
Bài 23: Cấu hình electron của 4 nguyên tố
9X : 1s22s22p5
11Y: 1s22s22p63s1
13Z: 1s22s22p63s23p1
8T: 1s22s22p4
Ion của 4 nguyên tố trên là:
A. X+, Y+, Z+, T2+.
B. X-, Y+, Z3+, T2-.
C. X-, Y2-, Z3+, T+.
D. X+, Y2+, Z+, T-.
Chọn đáp án: B.
Bài 24: Số proton của Na, Al, H, K lần lượt là 11,13,1,19 và số nơtron lần lượt là 12,14,1,20. Kí hiệu nào không đúng?
A. 2311Na B. 2713Al C. 21H D. 3819K
Chọn đáp án: D.
Giải thích: Kí hiệu đúng 3919K
Bài 25: Biết 1 mol nguyên tử sắt có khối lượng bằng 56g, một nguyên tử sắt có 26 electron. Số hạt electron có trong 5,6g sắt là:
A. 15,66.1024
B. 15,66.1021
C. 15,66.1022
D. 15,66.1023
Chọn đáp án: D.
Giải thích:
![]()
0.1 mol sắt → 0.1.6,022.1023 = 6.022.1022 nguyên tử sắt
Số electron = 6.022.1022.26=1.56572.1024 e
Bài 26: Nguyên tố Argon có 3 loại đồng vị có số khối bằng 36; 38 và A. Phần trăm số nguyên tử tương ứng của 3 đồng vị lần lượt bằng 0,34%; 0,06% và 99,6%. Biết 125 nguyên tử Ar có khối lượng 4997,5 đvc. Số khối A của đồng vị thứ 3 là:
A. 40 B. 40,5 C. 39 D. 39,8
Chọn đáp án: A.
Giải thích:
Nguyên tử khối trung bình của Ar: 4997,5:125=39.98(u)
Ta có phương trình:
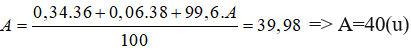
Bài 27: Trong tự nhiên Cu có 2 đồng vị 63Cu (75%) và 65Cu (25%). 2 mol Cu có khối lượng
A. 120g. B. 128g. C. 64g. D. 127g
Chọn đáp án: D.
Giải thích:
Nguyên tử khối trung bình của Cu:
![]()
2 mol Cu = 63,5.2=127 gam
Bài 28: So sánh khối lượng của electron với khối lượng hạt nhân nguyên tử, nhận định nào sau đây là đúng nhất ?
A. Khối lượng electron bằng khoảng 1/1840 khối lượng của hạt nhân nguyên tử.
B. Khối lượng của electron nhỏ hơn rất nhiều so với khối lượng của hạt nhân nguyên tử.
C. Một cách gần đúng, trong các tính toán về khối lượng nguyên tử, người ta bỏ qua khối lượng của các e.
D. B, C đều đúng.
Chọn đáp án: B
Bài 29: Mệnh đề nào sau đây không đúng?
A. Chỉ có nguyên tử magie mới có tỉ lệ số p : n = 1 : 1.
B. Chỉ có trong nguyên tử magie mới có 12 electron.
C. Chỉ có hạt nhân nguyên tử magie mới có 12 proton.
D. Nguyên tử magie có 3 lớp electron.
Chọn đáp án: A.
Giải thích: Một số nguyên tố khác cũng có p : n = 1 : 1 như 6C, 20Ca….
Bài 30: Nguyên tử X, ion Y2+ và ion Z- đều có cấu hình electron là 1s22s22p6. X, Y, Z là kim loại, phi kim hay khí hiếm
A. X: Phi kim; Y: Khí hiếm; Z: Kim loại.
B. X: Khí hiếm; Y: Phi kim; Z: Kim loại.
C. X: Khí hiếm; Y: Kim loại; Z: Phi kim.
D. X: Khí hiếm; Y: Phi kim; Z: Kim loại.
Chọn đáp án: C.
Giải thích:
Cấu hình e của Y: 1s22s22p63s2 (có 2 e lớp ngoài cùng)
Cấu hình e của Z: 1s22s22p5 (có 7 e lớp ngoài cùng).
Khi nguyên tử có 1,2,3 e lớp ngoài cùng là kim loại, có 5,6,7 e lớp ngoài cùng là phi kim
Trên đây VnDoc đã giới thiệu tới các bạn lý thuyết Hóa học 10: Trắc nghiệm chương 1: Nguyên tử phần 7. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 10, Giải bài tập Hóa học lớp 10, Giải bài tập Vật Lí 10, Tài liệu học tập lớp 10 mà VnDoc tổng hợp và giới thiệu tới các bạn đọc.








