Hóa học 10 bài 13: Liên kết cộng hóa trị
Chuyên đề Hóa học lớp 10: Liên kết cộng hóa trị được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Lý thuyết: Liên kết cộng hóa trị
A/ Lý thuyết Hóa học 10 bài 13
I. Sự hình thành liên kết cộng hóa trị bằng cặp electron chung
1. Sự hình thành phân tử đơn chất
- Liên kết cộng hóa trị là liên kết được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron chung.
- Mỗi cặp electron chung tạo nên một liên kết cộng hóa trị.
- Các phân tử đơn chất tạo nên từ các nguyên tử của cùng một nguyên tố (có độ âm điện như nhau), nên các cặp electron chung không bị hút lệch về phía nguyên tử nào. Do đó, liên kết trong các phân tử đó không bị phân cực. Đó là liên kết cộng hóa trị không cực.
2. Sự hình thành phân tử hợp chất
- Liên kết cộng hóa trị trong đó cặp electron chung bị lệch về phía nguyên tử có độ âm điện lớn hơn được gọi là liên kết cộng hóa trị có cực hay liên kết cộng hóa trị phân cực.
- Với những phân tử có cấu tạo thẳng như CO2: Liên kết giữa hai nguyên tử oxi và cacbon là phân cực, nhưng phân tử CO2 có cấu tạo thẳng nên độ phân cực của hai liên kết đôi (C=O) triệt tiêu nhau, kết quả là toàn bộ phân tử không bị phân cực.
- Liên kết cho - nhận
+ Trong một số trường hợp, cặp electron chung chỉ do một nguyên tử đóng góp thì liên kết giữa hai nguyên tử là liên kết cho - nhận.
+ Điều kiện để có liên kết cho – nhận:
* Có nguyên tử còn dư một cặp electron chưa sử dụng.
* Có nguyên tử còn thiếu một cặp electron.
Ví dụ: Đối với phân tử SO2 công thức electron, công thức cấu tạo có thể biểu diễn như sau:
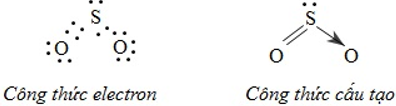
3. Tính chất của các chất có liên kết cộng hóa trị
- Các chất mà phân tử chỉ có liên kết cộng hóa trị có thể là chất rắn như đường, lưu huỳnh, iot, ... có thể là chất lỏng: nước, ancol,... hoặc chất khí như khí cacbonic, clo, hiđro, ...
- Các chất có cực như ancol etylic, đường, ... tan nhiều trong dung môi có cực như nước.
- Phần lớn các chất không cực như iot, các chất hữu cơ không cực tan trong dung môi không cực như benzen, cacbon tetraclorua, ...
- Nói chung, các chất chỉ có liên kết cộng hóa trị không cực không dẫn điện ở mọi trạng thái.
II. Liên kết cộng hóa trị và sự xen phủ các obitan nguyên tử
1. Sự xen phủ của các obitan nguyên tử khi hình thành các phân tử đơn chất
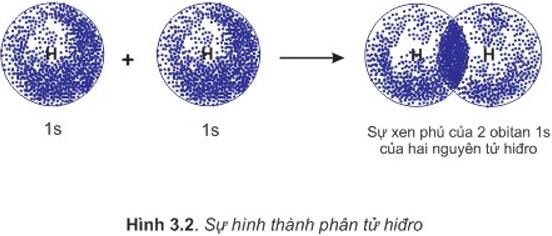
a. Sự hình thành phân tử H2
- Để hình thành liên kết giữa hai nguyên tử H trong phân tử hiđro, hai obitan 1s của hai nguyên tử H xen phủ với nhau tạo ra vùng xen phủ giữa hai hạt nhân nguyên tử.
- Ngoài lực đẩy tương hỗ giữa hai proton và hai electron còn có lực hút giữa các electron vơi hai hạt nhân hướng về tâm phân tử.
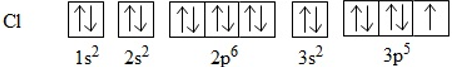
b. Sự hình thành phân tử Cl2
Để giải thích sự hình thành liên kết Cl−Cl, có thể dựa vào cấu hình electron của mỗi nguyên tử clo:
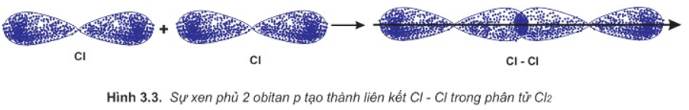
Sự hình thành liên kết giữa hai nguyên tử clo là do sự xen phủ giữa hai obitan p chứa electron độc thân của mỗi nguyên tử clo:
2. Sự xen phủ của các obitan nguyên tử khi hình thành các phân tử hợp chất
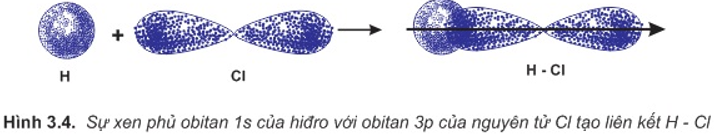
a. Sự hình thành phân tử HCl
Liên kết hóa học trong phân tử hợp chất HCl được hình thành nhờ sự xenphủ giữa obitan 1s của nguyên tử hiđro và obitan 3p có 1 electron độc thân của nguyên tử clo.
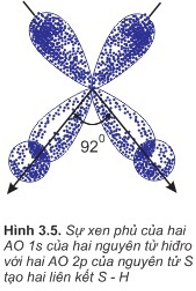
b. Sự hình thành phân tử H2S
- Là sự xen phủ giữa obitan 1s của các nguyên tử hiđro và 2 obitan p của nguyên tử lưu huỳnh.
- 2 obitan p có 2 electron độc thân của nguyên tử S xen phủ với 2 obitan 1s có của 2 nguyên tử H tạo nên liên kết S−H.
B/ Trắc nghiệm Hóa học 10 bài 13
Câu 1: Phát biểu nào sau đây là đúng với liên kết cộng hóa trị?
A. Liên kết cộng hóa trị là liên kết mà cặp electron dùng chung lệch về phía một nguyên tử.
B. Liên kết cộng hóa trị là liên kết giữa các phi kim với nhau
C. Liên kết cộng hóa trị là liên kết được tạo nên giữa hai nguyên tử bằng những electron dùng chung
D. Liên kết cộng hóa trị là liên kết được hình thành do sự dùng chung electron của hai nguyên tử khác nhau
Câu 2: Liên kết cộng hóa trị không cực được hình thành
A. Do lực hút tĩnh điện giữa các ion mang điện tích trái dấu
B. Từ một hay nhiều cặp electron dùng chung và cặp electron dùng chung này lệch về phía nguyên tử có độ âm điện lớn hơn
C. Giữa các kim loại điển hình và các phi kim điển hình
D. Từ một hay nhiều cặp electron dùng chung và cặp electron này nằm chính giữa đường nối tâm 2 hạt nhân
Câu 3: Liên kết hóa học trong phân tử HCl là
A. Liên kết ion
B. Liên kết cộng hóa trị không phân cực
C. Liên kết cộng hóa trị phân cực
D. Liên kết cho nhận
Câu 4: Liên kết cộng hóa trị được tạo thành bằng
A. Sự chuyển hẳn electron từ nguyên tử này sang nguyên tử khác.
B. Sự góp chung cặp electron của hai nguyên tử.
C. Cặp electron dùng chung giữa hai nguyên tử, nhưng cặp electron này chỉ do một nguyên tử cung cấp.
D. Sự tương tác giữa các nguyên tử và ion ở nút mạng tinh thể với dòng electron tự do.
Câu 5: Phân tử chất nào sau đây chỉ có các liên kết cộng hóa trị phân cực?
A. H2O
B. C2H6
C. N2
D. MgCl2
Câu 6: Phân tử chất nào sau đây ít phân cực nhất?
A. HCl
B. HF
C. HI
D. HBr
Câu 7: Liên kết trong phân tử chất nào sau đây mang nhiều tính chất cộng hóa trị nhất?
A. KCl
B. AlCl3
C. NaCl
D. MgCl2
Câu 8: Dãy chất nào sau đây được sắp xếp theo chiều tăng dần sự phân cực liên kết trong phân tử?
A. Cl2, NaCl, HCl
B. HCl, Cl2, NaCl
C. NaCl, Cl2, HCl
D. Cl2, HCl, NaCl
Câu 9: Cho biết độ âm điện của O là 3,44 và của Si là 1,9. Liên kết hình thành trong phân tử SiO2 là liên kết:
A. Cộng hóa trị phân cực
B. Cho nhận
C. Cộng hóa trị không phân cực
D. Ion
Câu 10: Phân tử chất nào sau đây có liên kết cho – nhận?
A. H2O
B. NH3
C. H2O2
D. HNO3
Câu 11: Dãy nào sau đây gồm các chất đều có liên kết π trong phân tử?
A. C2H4, O2, N2, H2S
B. CH2, H2O, C2H4, C3H6
C. C2H4, C2H2, O2, N2
D. C3H8, CO2, SO2, OExtra close brace or missing open brace
Câu 12: Số liên kết π và liên kết σ trong phân tử C2H4 là
A. 1 và 5
B. 2 và 5
C. 1 và 4
D. 2 và 4
Câu 13: Dãy nào sau đây gồm các chất mà phân tử đều không bị phân cực?
A. HBr, CO2, CH4
B. Cl2, CO2, C2H2
C. NH3, Br2, C2H4
D. HCl, C2H2, CH4
Câu 14: Liên kết hóa học trong phân tử HCl được hình thành do
A. Sự xen phủ giữa obitan 1s của nguyên tử H và các obitan 3p có 3 electron độc thân của nguyên tử Cl
B. Lực hút tĩnh điện giữa ion H+ và ion Cl−
C. sự xen phủ giữa obitan 1s của nguyên tử H và các obitan 3p của nguyên tử Cl
D. sự xen phủ giữa obitan 1s của nguyên tử H và các obitan 3s của nguyên tử Cl
Câu 15: Hợp chất nào dưới đây chứa đồng thời cả liên kết cộng hóa trị và liên kết ion?
A. MgO
B. H2SO4
C. Na2SO4
D. HCl
Câu 16: Dãy nào sau đây gồm các chất mà phân tử đều chỉ có liên kết cộng hóa trị phân cực?
A. O2, H2O, NH3
B. H2O, HCl, H2S
C. HCl, O3, H2S
D. HCl, Cl2, H2O
Câu 17: X, Y là những nguyên tố có đơn vị điện tích hạt nhân lần lượt là 6, 16. Công thức và liên kết hợp chất tạo thành từ X và Y là
A. XY và liên kết cộng hóa trị.
B. X2Y và liên kết ion.
C. XY và liên kết ion.
D. XY2 và liên kết cộng hóa trị.
Câu 18: Cho các phân tử N2, HCl, NaCl, MgO. Các phân tử đều có liên kết cộng hóa trị là
A. N2 và HCl
B. HCl và MgO
C. N2 và NaCl
D. NaCl và MgO
Câu 19: Tổng số hạt proton, nowtron, electron của nguyên tử nguyên tố R thuộc nhóm VIIA là 28. Công thức hợp chất của R với hidro là
A. HF
B. HCl
C. SiH4
D. NH3
Câu 20: Đặc điểm về liên kết trong phân tử nito là:
A. Có 1 liên kết σ và 1 liên kết π
B. Có 1 liên kết ba
C. Có 1 liên kết σ và 2 liên kết π
D. Có 2 liên kết σ và 1 liên kết π
Câu 21: Để đánh giá về độ phân cực của một liên kết, người ta dựa vào hiệu độ âm điện (HS. ĐAĐ). Phát biểu nào sau đây không đúng?
A. 0 ≤ (HS. ĐAĐ) ≤ 0,4: Liên kết cộng hóa trị không phân cực
B. 0,4 ≤ (HS. ĐAĐ) |leq 1,7 : Liên kết cộng hóa trị phân cực
C. (HS. ĐAĐ) ≥ 1, 7: liên kết ion
D. (HS. ĐAĐ) < 1,7: Liên kết ion
Câu 22: Liên kết cộng hóa trị tồn tại do
A. Các đám mây electron.
B. Các electron hoá trị.
C. Các cặp electron dùng chung.
D. Lực hút tĩnh điện yếu giữa các nguyên tử.
Câu 23: Đa số các hợp chất cộng hóa trị có đặc điểm là
A. Có thể hòa tan trong dung môi hữu cơ.
B. Nhiệt độ nóng chảy và nhiệt độ sôi cao.
C. Có khả năng dẫn điện khi ở thể lỏng hoặc nóng chảy.
D. Khi hòa tan trong nước thành dung dịch điện li.
Câu 24: Dãy phân tử nào cho dưới đây đều có liên kết cộng hoá trị không phân cực?
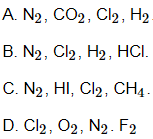
Câu 25: Khả năng hoạt động của các phi kim giảm dần theo thứ tự sau: F, O, Cl. Liên kết trong phân tử nào sau đây có độ âm phân cực lớn nhất?
A. FCl
B. F2O
C. Cl2O
D. Cl2
Đáp án
| 1C | 2D | 3C | 4B | 5 | 6A | 7D | 8 | 9A | 10D |
| 11C | 12A | 13B | 14A | 15C | 16B | 17D | 18A | 19A | 20C |
| 21D | 22C | 23A | 24D | 25A |
-----------------------------------------
Trong phần chuyên đề trên đây chúng ta có thể hiểu biết thêm về Liên kết cộng hóa trị gồm các khái niệm về sự hình thành phân tử đơn chất, hợp chất...
Như vậy VnDoc đã giới thiệu các bạn tài liệu Lý thuyết Hóa học lớp 10 bài 13: Liên kết cộng hóa trị. Mời các bạn tham khảo thêm tài liệu: Trắc nghiệm Sinh học 10, Giải bài tập Sinh học lớp 10, Giải Vở BT Sinh Học 10, Giải bài tập Sinh học 10 ngắn nhất, Tài liệu học tập lớp 10.
Để tiện trao đổi, chia sẻ kinh nghiệm về giảng dạy và học tập các môn học lớp 10, VnDoc mời các thầy cô giáo, các bậc phụ huynh và các bạn học sinh truy cập nhóm riêng dành cho lớp 10 sau: Nhóm Tài liệu học tập lớp 10. Rất mong nhận được sự ủng hộ của các thầy cô và các bạn.








