Trắc nghiệm chương 6: Nhóm Oxi, Lưu huỳnh phần 4
Chuyên đề Hóa học lớp 10: Trắc nghiệm chương 6: Nhóm Oxi, Lưu huỳnh phần 4 được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Bài tập trắc nghiệm chương 6
Bài 1: Trường hợp không xảy ra phản ứng hóa học là
A. 3O2 + 2H2S → 2H2O + 2SO2.
B. FeCl2 + H2S → FeS + 2HCl.
C. O3 + 2KI + H2O → 2KOH + I2 + O2.
D. Cl2 + 2NaOH → NaCl + NaClO + H2O.
Hướng dẫn giải
Đáp án B.
Do FeS tan được trong HCl.
FeS + 2HCl → FeCl2 + H2S
Bài 2: Cho 1,3 gam kẽm tác dụng với 0,32 gam lưu huỳnh sản phẩm thu được sau khi phản ứng xảy ra hoàn toàn là
A. ZnS. B. ZnS và S. C. ZnS và Zn. D. ZnS, Zn và S.
Hướng dẫn giải
Đáp án C.
Zn + S → ZnS
0,02 0,01 (mol)
Sau phản ứng thu được: ZnS: 0,01 mol và Zn dư 0,01 mol.
Bài 3: Dẫn 2,24 lít khí H2S vào dung dịch chứa 0,2 mol NaOH thu được dung dịch chứa chất tan là
A. hai muối NaHS và Na2S.
B. NaHS.
C. Na2S.
D. Na2S và NaOH.
Hướng dẫn giải
Đáp án C.
nH2S=0,1 mol ⇒ nNaOH/nH2S=0,2/0,1=2 ⇒ Tạo Na2S
Bài 4: Hòa tan hoàn toàn 3,22 gam hỗn hợp X gồm Fe, Mg và Zn bằng một lượng vừa đủ dung dịch H2SO4 loãng, thu được 1,344 lít hiđro (ở đktc) và dung dịch chứa m gam muối. Giá trị của m là?
A. 9,52. B. 10,27. C. 8,98. D. 7,25.
Hướng dẫn giải
Đáp án C
nH2 = nH2SO4=1,344/22,4=0,06 mol
mmuối = mKL + mgốc axit = 3,22 + 0,06.96 = 8,98 (g)
Bài 5: Cho phản ứng hoá học: H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl. Vai trò của H2S trong phản ứng là
A. Chất khử.
B. Môi trường.
C. Chất oxi hóa.
D. Vừa oxi hóa, vừa khử.
Hướng dẫn giải
Đáp án A.
Bài 6: Lưu huỳnh đioxit có thể tham gia phản ứng:
(1) SO2 + 2Mg![]() 2MgO + S;
2MgO + S;
(2) SO2+ Br2 + H2O ![]() 2HBr + H2SO4. Tính chất của SO2 được diễn tả đúng nhất là
2HBr + H2SO4. Tính chất của SO2 được diễn tả đúng nhất là
A. SO2 thể hiện tính oxi hoá.
B. SO2 thể hiện tính khử.
C. SO2 vừa oxi hóa vừa khử.
D. SO2 là oxit axit.
Hướng dẫn giải Đáp án C.
Bài 7: Cho phản ứng Al + H2SO4 đặc![]() Al2(SO4)3 + SO2 + H2O. Hệ số cân bằng của H2SO4 là
Al2(SO4)3 + SO2 + H2O. Hệ số cân bằng của H2SO4 là
A. 4. B. 8. C. 6. D. 3.
Hướng dẫn giải
Đáp án C
2Al + 6H2SO4 đặc![]() Al2(SO4)3 + 3SO2 +6 H2O
Al2(SO4)3 + 3SO2 +6 H2O
Bài 8: Trong số những tính chất sau, tính chất nào không là tính chất của axit H2SO4 đặc nguội?
A. Tan trong nước, tỏa nhiệt.
B. Làm hóa than vải, giấy, đường.
C. Hòa tan được kim loại Al và Fe.
D. Háo nước.
Hướng dẫn giải Đáp án C.
Bài 9: Trong tự nhiên có rất nhiều nguồn sinh ra khí H2S như sự phân huỷ rác, chất thải... nhưng không có sự tích tụ H2S trong không khí. Nguyên nhân chính là
A. H2S ở thể khí.
B. H2S dễ bị oxi hóa trong không khí.
C. H2S dễ bị phân huỷ trong không khí.
D. H2S nặng hơn không khí.
Hướng dẫn giải Đáp án B.
Bài 10: Cho m gam FeO tác dụng hết với H2SO4 đặc nóng (dư), thoát ra 0,112 lít (ở đktc) khí SO2(là sản phẩm khử duy nhất). Giá trị của m là
A. 7,2g. B. 3,6g. C. 0,72g. D. 0,36g.
Hướng dẫn giải
Đáp án C.
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
0,01 0,005 (mol)
mFeO = 0,01.72 = 0,72 (g)
Bài 11: Hoà tan hết hỗn hợp gồm Zn và Cu cần vừa đủ 200ml dung dịch H2SO4 loãng 0,1M thu được V lít khí (đktc). V có giá trị là
A. 0,224 lít. B. 2,24 lít. C. 4,48 lít. D. 0,448 lít.
Hướng dẫn giải
Đáp án C.
Cu không phản ứng với H2SO4 loãng
Zn + H2SO4 → ZnSO4 + H2
0,02 0,02
V = 0,02.22,4 = 4,48 (l)
Bài 12: Người ta thường dùng các vật dụng bằng bạc để cạo gió cho người bị trúng gió (khi người bị mệt mỏi, chóng mặt…do trong cơ thể tích tụ các khí độc như H2S…). Khi đó vật bằng bạc bị đen do phản ứng:
4Ag + O2 + 2H2S → 2Ag2S + 2H2O Câu nào diễn tả đúng tính chất của các chất phản ứng?
A. Ag là chất oxi hoá, H2S là chất khử.
B. H2S là chất khử, O2 là chất oxi hoá.
C. Ag là chất khử, O2 là chất oxi hoá.
D. H2S vừa là chất oxi hoá, vừa là chất khử, Ag là chất khử.
Hướng dẫn giải Đáp án C.
Bài 13: Dẫn khí H2S vào dung dịch KMnO4 và H2SO4 loãng, hiện tượng quan sát được là:
A. Dung dịch không màu chuyển sang màu tím.
B. Dung dịch màu tím bị vẩn đục màu vàng.
C. Màu tím của dung dịch KMnO4 chuyển sang màu vàng.
D. Màu tím của dung dịch KMnO4 chuyển sang không màu và có vẩn đục màu vàng.
Hướng dẫn giải
Đáp án D.
5H2S + 2KMnO4 + 3H2SO4 → 5S + 2MnSO4 + 8H2O + K2SO4
Bài 14: Thực hiện các phản ứng sau:
(a) 2KClO3![]() 2KCl + 3O2
2KCl + 3O2
(b) 2KMnO4![]() K2MnO4 + MnO2 + O2
K2MnO4 + MnO2 + O2
(c) 2H2O![]() 2H2 + O2
2H2 + O2
(d) 2Cu(NO3)2 ![]() 2CuO + 4NO2 + O2
2CuO + 4NO2 + O2
Có bao nhiêu trường hợp thường dùng để điều chế oxi trong phòng thí nghiệm?
A. 2. B. 4. C. 3. D. 5.
Hướng dẫn giải
Đáp án A.
Các phản ứng là a,b
Bài 15: Thuốc thử dùng để phân biệt 3 dung dịch H2SO4 loãng, Ba(OH)2, HCl đựng trong lọ mất nhãn là
A. Cu.
B. dung dịch BaCl2.
C. dung dịch NaNO3.
D. dung dịch NaOH.
Hướng dẫn giải
Đáp án B.
- Dùng BaCl2 nhận ra H2SO4 nhờ hiện tượng kết tủa trắng.
- Dùng H2SO4 vừa nhận ra cho vào hai ống nghiệm đựng hai chất còn lại.
+ Có kết tủa trắng → Ba(OH)2
+ Không hiện tượng → HCl.
BaCl2 + H2SO4 → BaSO4 + 2HCl
Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
Bài 16: Hòa tan hoàn toàn 2,4 gam kim loại Mg vào dung dịch H2SO4 đặc, nóng, giả sử chỉ thu được V lít khí SO2 là sản phẩm khử duy nhất (đktc). Giá trị của V là
A. 0,672 lít. B. 6,72 lít. C. 0,448 lít. D. 4,48 lít.
Hướng dẫn giải:
Đáp án D.
nMg = 0,1 (mol)
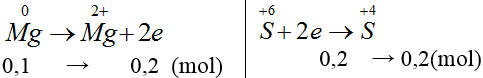
VSO2=0,2.22,4=4,48(l)
Bài 17: Oxi có thể thu được từ phản ứng nhiệt phân chất nào sau đây?
A. KMnO4. B. NaHCO3. C. (NH4)2SO4. D. CaCO3.
Hướng dẫn giải:
Đáp án A.
2KMnO4![]() K2MnO4 + MnO2 + O2
K2MnO4 + MnO2 + O2
Bài 18: Ứng dụng nào sau đây không phải của ozon?
A. Tẩy trắng tinh bột, dầu ăn.
B. Chữa sâu răng.
C. Điều chế oxi trong phòng thí nghiệm.
D. Sát trùng nước sinh hoạt.
Hướng dẫn giải: Đáp án C.
Bài 19: Một chất dùng để làm sạch nước, dùng để chữa sâu răng và có tác dụng bảo vệ các sinh vật trên trái đất không bị bức xạ cực tím. Chất này là
A. Ozon. B. Clo. C. Oxi. D. Flo.
Hướng dẫn giải: Đáp án A.
Bài 20: Hoà tan hoàn toàn 2,16 gam kim loại M hóa trị III bởi lượng dư dung dịch H2SO4 đặc, nóng thu được 2,688 gam khí SO2 (là sản phẩm khử duy nhất). M là
A. Fe. B. Cu. C. Zn. D. Al.
Hướng dẫn giải:
Đáp án D.
Ta có:
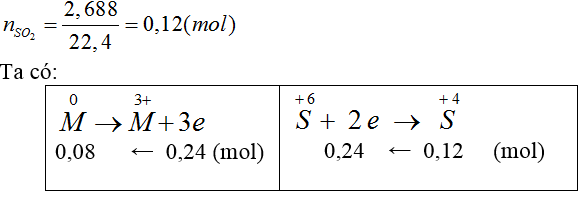
MM=2,16/0,08=27 ⇒ Al
Bài 21: Có thể điều chế O2 bằng cách phân huỷ KMnO4, KClO3, H2O2. Nếu lấy cùng một lượng các chất trên đem phân huỷ hoàn toàn thì thể tích oxi trong cùng điều kiện thu được
A. Từ KMnO4 là lớn nhất
B. Từ KClO3 là lớn nhất
C. Từ H2O2 là lớn nhất
D. bằng nhau
Hướng dẫn giải
Đáp án B
PTHH: 2KMnO4![]()
K2MnO4 + MnO2 + O2
2H2O2![]() 2H2O + O2
2H2O + O2
2KClO3 ![]() 2KCl + 3O2
2KCl + 3O2
Bài 22: Có 3 dung dịch đựng trong các bình mất nhãn: HCl, Na2SO4, Na2SO3. Có thể chọn thuốc thử nào sau đây để nhận biết ba chất trên?
A. H2SO4 B. NaNO3 C. AgNO3 D. BaCl2
Hướng dẫn giải
Đáp án D
Lấy BaCl2 cho lần lượt vào 3 mẫu thử.
Các phương trình phản ứng xảy ra:
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
BaCl2 + Na2SO3 → BaSO3↓ + 2NaCl
Mẫu không có kết tủa là HCl. Lấy HCl cho vào kết tủa, BaSO3 tan.
BaSO3 + 2HCl → BaCl2 + SO2 + H2O
Bài 23: Lưu huỳnh đioxit có thể tham gia các phản ứng sau:
SO2 + Br2+ 2H2O → 2HBr + H2SO4 (1)
2H2S + SO2 → 3S + 2H2O (2).
Câu nào sau đây diễn tả không đúng tính chất của các chất trong những phản ứng trên?
A. phản ứng (2): SO2 vừa là chất khử, vừa là chất oxi hóa.
B. phản ứng (2): SO2 là chất oxi hóa, H2S là chất khử.
C. phản ứng (1): SO2 là chất khử, Br2 là chất oxi hóa.
D. phản ứng (1): Br2là chất oxi hóa, phản ứng (2): H2S là chất khử
Hướng dẫn giải Đáp án A
Bài 24: Để đánh giá độ nhiễm bẩn không khí của một nhà máy, người ta lấy hai lít không khí rồi dẫn qua dung dịch Pb(NO3)2 dư thấy có kết tủa màu đen xuất hiện. Hiện tượng này chứng tỏ trong không khí có hiện diện khí nào sau?
A. CO2. B. H2S. C. NH3. D. SO2.
Hướng dẫn giải
Đáp án B.
Pb(NO3)2 + H2S → PbS + 2HNO3
Bài 25: Dung dịch X chứa: FeCl3; CuCl2; AlCl3; NaCl, CdCl2; ZnCl2; MgCl2. Sục khí H2S đến dư vào dung dịch X. Số kết tủa khác nhau thu được là:
A. 1. B. 2. C. 4. D. 3.
Hướng dẫn giải
Đáp án D
Các kết tủa thu được là: S; CuS; CdS
2FeCl3 + H2S → 2FeCl2 + S + 2HCl
CuCl2 + H2S → CuS + 2HCl
CdCl2 + H2S → CdS + 2HCl
Bài 26: Để nhận biết hai bình chứa khí không màu CO2 và SO2, cách làm nào sau đây không đúng?
A. Cho mỗi khí vào nước Br2.
B. Cho từ từ đến dư mỗi khí vào nước vôi trong.
C. Cho mỗi khí vào dung dịch H2S.
D. Cho mỗi khí vào dung dịch KMnO4.
Hướng dẫn giải
Đáp án B
Do cả SO2 và CO2 đều phản ứng với Ca(OH)2 tạo kết tủa CaSO3 và CaCO3 đều màu trắng, sau đó đều hòa tan kết tủa, không thể phân biệt được.
Bài 27: Đốt cháy hoàn toàn 17,4 gam hỗn hợp Mg và Al trong khí oxi (dư) thu được 30,2 gam hỗn hợp oxit. Thể tích khí oxi (đktc) đã tham gia phản ứng là
A. 17,92 lít. B. 8,96 lít. C. 11,20 lít. D. 4,48 lít.
Hướng dẫn giải
Đáp án B.
Bảo toàn khối lượng: nO2=(30,2-17,4)/32=0,4 mol
⇒ V = 0,4.22,4 = 8,96 (lít)
Bài 28: Dẫn a mol khí H2S vào dung dịch chứa b mol NaOH. Để thu được muối trung hòa thì:
A. a/b > 2
B. b/a > 2
C. b/a ≥ 2
D. 1 < b/a < 2
Hướng dẫn giải
Đáp án C
H2S + 2NaOH → Na2S + H2O
a b
⇒ b/a ≥2
Bài 29: Hấp thụ 2,24 lít khí SO2 (đktc) vào 300 ml dung dịch NaOH 1M, thu được dung dịch X. Chất tan trong X là
A. Na2SO3 B. NaHSO3 C. Na2SO3, NaOH D. Na2SO3, NaHSO3
Hướng dẫn giải
Đáp án C.
nSO2=0,1 mol , nNaOH = 1.0,3 = 0,3 mol
nNaOH/nSO2=0,3/0,1=3
Tạo Na2SO3, NaOH dư
Bài 30: Dẫn V lít (đktc) khí SO2 vào 200 ml dung dịch KOH 1M thu được 12 gam muối KHSO3. Vậy V có giá trị là:
A. 2,24 lit B. 3,36 lit C. 4,48 lit D. 5,6 lit
Hướng dẫn giải
Đáp án B.
nKHSO3=0,1 mol
Các phương trình phản ứng xảy ra:
SO2 + KOH → KHSO3
0,1 0,1 0,1 mol
SO2 + 2KOH → K2SO3 + H2O
0,05 0,1 mol
Tổng số mol SO2 = 0,15 mol
→ V = 3,36 lit
Trên đây VnDoc đã giới thiệu tới các bạn lý thuyết Hóa học 10: Trắc nghiệm chương 6: Nhóm Oxi, Lưu huỳnh phần 4. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 10, Giải bài tập Hóa học lớp 10, Giải bài tập Vật Lí 10, Tài liệu học tập lớp 10 mà VnDoc tổng hợp và giới thiệu tới các bạn đọc.








