Sự lai hóa các obitan nguyên tử - Sự hình thành liên kết đơn, liên kết đôi và liên kết ba
Chuyên đề Hóa học lớp 10: Sự lai hóa các obitan nguyên tử - Sự hình thành liên kết đơn, liên kết đôi và liên kết ba được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Lý thuyết: Sự lai hóa các obitan nguyên tử
I. Khái niệm về sự lai hóa
- Sự lai hóa obitan nguyên tử là sự tổ hợp "trộn lẫn" một số obitan trong một nguyên tử để được từng ấy obitan lai hóa giống nhau nhưng định hướng khác nhau trong không gian.
- Nguyên nhân của sự lai hóa là các obitan hóa trị ở các phân lớp khác nhau có năng lượng và hình dạng khác nhau cần phải đồng nhất để tạo được liên kết bền với các nguyên tử khác.
II. Các kiểu lai hóa thường gặp
1. Lai hóa sp
- Là sự tổ hợp 1 obitan s với 1 obitan p tạo thành 2 obitan lai hóa sp.
- 2 obitan sp này nằm thẳng hàng với nhau, hướng về 2 phía, đối xứng nhau.
- Góc liên kết bằng 180o.
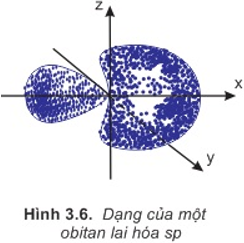
- Mô hình sự lai hóa sp và sự xen phủ các obitan liên kết:

2. Lai hóa sp2
- Là sự tổ hợp 1 obitan s với 2 obitan p tạo thành 3 obitan lai hóa sp2.
- 3 obitan sp2này nằm trong 1 mặt phẳng, định hướng từ tâm đến đỉnh của tam giác đều.
- Góc liên kết bằng 120o.
- Mô hình sự lai hóa sp2 và sự hình thành liên kết trong phân tử BF3:
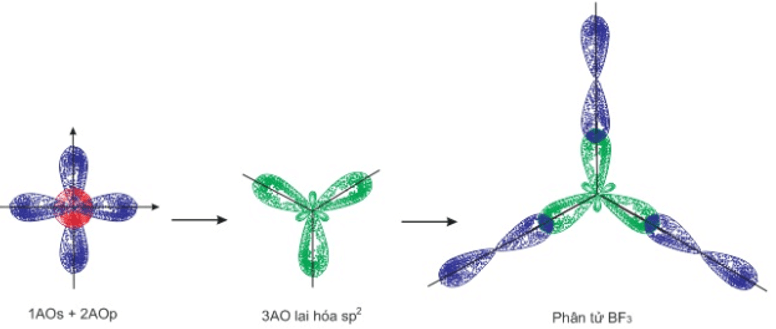
3. Lai hóa sp3
- Là sự tổ hợp 1 obitan s với 3 obitan p tạo thành 4 obitan lại hóa sp3.
- Định hướng từ tâm đến 4 đỉnh của hình tứ diện đều.
- Các trục đối xứng của chúng tạo với nhau 1 góc 109o28’.
- Mô hình sự lai hóa sp3 và sự hình thành liên kết trong phân tử CH4.
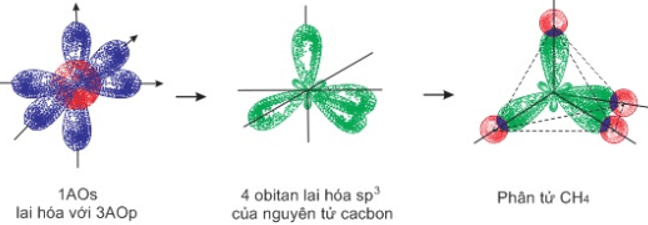
III. Nhận xét chung về thuyết lai hóa
- Thuyết lai hóa có vai trò giải thích hơn là tiên đoán dạng hình học của phân tử.
- Thường sau khi biết phân tử có dạng hình học gì, có những góc liên kết xác định được bằng thực nghiệm là bao nhiêu, mới dùng sự lai hóa để giải thích. Nếu cho một phân tử hay ion mà không có dữ kiện nào, thì thuyết lai hóa sẽ không tiên đoán được là có sự lai hóa tứ diện hay vuông phẳng.
IV. Sự xen phủ trục và xen phủ bên
1. Sự xen phủ trục
- Là sự xen phủ trong đó trục của các obitan tham gia liên kết song song với nhau và vuông góc vưới đường nối tâm của hai nguyên tử liên kết.
- Sự xen phủ trục tạo liên kết σ.
- Mô hình sự xen phủ trục của các obitan tạo liên kết:
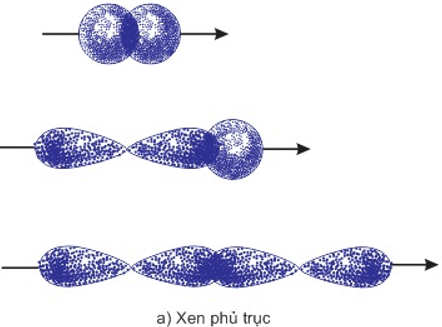
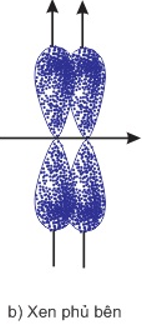
2. Sự xen phủ bên
- Là sự xen phủ trong đó trục của các obitan tham gia liên kết song song với nhau và vuông góc với đường nối tâm của 2 nguyên tử liên kết.
- Sự xen phủ bên tạo liên kết π.
- Mô hình sự xen phủ trục của các obitan tạo liên kết:
V. Sự tạo thành liên kết đơn, liên kết đôi và liên kết ba
1. Liên kết đơn
- Luôn là các liên kết σ, được tạo thành từ sự xen phủ trục.
- Thường bền vững
- Mỗi liên kết đơn được biểu diễn bằng 1 gạch nối giữa kí hiệu của 2 nguyên tử đó.
2. Liên kết đôi
- Gồm 1 liên kết σ và 1 liên kết π.
- Các liên kết π kém bền hơn các liên kết σ.
- Mỗi liên kết đôi được biểu diễn bởi 2 gạch nối giữa kí hiệu của 2 nguyên tử đó.
- Ví dụ: liên kết trong phân tử etilen.

3. Liên kết ba
- Gồm 1 liên kết σ và 1 hay nhiều liên kết π gọi là liên kết bội.
- Mỗi liên kết đôi được biểu diễn bởi 3 gạch nối giữa kí hiệu của 2 nguyên tử đó.
Trong phần chuyên đề trên đây chúng ta có thể hiểu biết thêm về Sự lai hóa các obitan nguyên tử - Sự hình thành liên kết đơn, liên kết đôi và liên kết ba gồm các khái niệm về sự lai hóa, thuyết lai hóa, các loại lai hóa...
Trên đây VnDoc đã giới thiệu tới các bạn lý thuyết Hóa học 10: Sự lai hóa các obitan nguyên tử - Sự hình thành liên kết đơn, liên kết đôi và liên kết ba. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 10, Giải bài tập Hóa học lớp 10, Giải bài tập Vật Lí 10, Tài liệu học tập lớp 10 mà VnDoc tổng hợp và giới thiệu tới các bạn đọc.








