Cách cân bằng phương trình Hóa học 10
Đây là tài liệu Cao cấp - Chỉ dành cho Thành viên VnDoc ProPlus.
- Tải tất cả tài liệu lớp 10 (Trừ Giáo án, bài giảng)
- Trắc nghiệm không giới hạn


Cân bằng phương trình oxi hóa khử
Cách cân bằng phương trình hóa học lớp 10 được VnDoc biên soạn hướng dẫn các bạn cách cân bằng oxi hóa khử cũng như đưa ra các dạng bài tập để luyện tập. Mời các bạn cùng theo dõi bài viết dưới đây nhé.
I. Số oxi hoá
1. Khái niệm
Số oxi hóa là điện tích quy ước của nguyên tử trong phân tử khi coi tất cả các electron liên kết đều chuyển hoàn toàn về nguyên tử có độ âm điện lớn hơn.
Số oxi hóa được viết ở dạng đại số, dấu viết trước, số viết sau.
Ví dụ"
Xét phân tử NaCl: Nguyên tử Na nhường 1 electron cho nguyên tử Cl, khi đó nguyên tử Na trở thành ion dương mang điện tích 1+ (số oxi hóa của K là +1) và nguyên tử Cl nhận 1 electron của nguyên tử K trở thành ion âm mang điện tích –1 (số oxi hóa của Cl là – 1).
2. Quy tắc xác định số oxi hóa
Quy tắc 1: Trong đơn chất, số oxi hóa của nguyên tử bằng 0.
Ví dụ: H2; N2; O2; Fe; Zn ....
Quy tắc 2: Trong phân tử các hợp chất, thông thường số oxi hóa của hydrogen là +1, của oxygen là -2, các kim loại điển hình có số oxi hóa dương và có giá trị bằng số electron hóa trị.
Ví dụ:
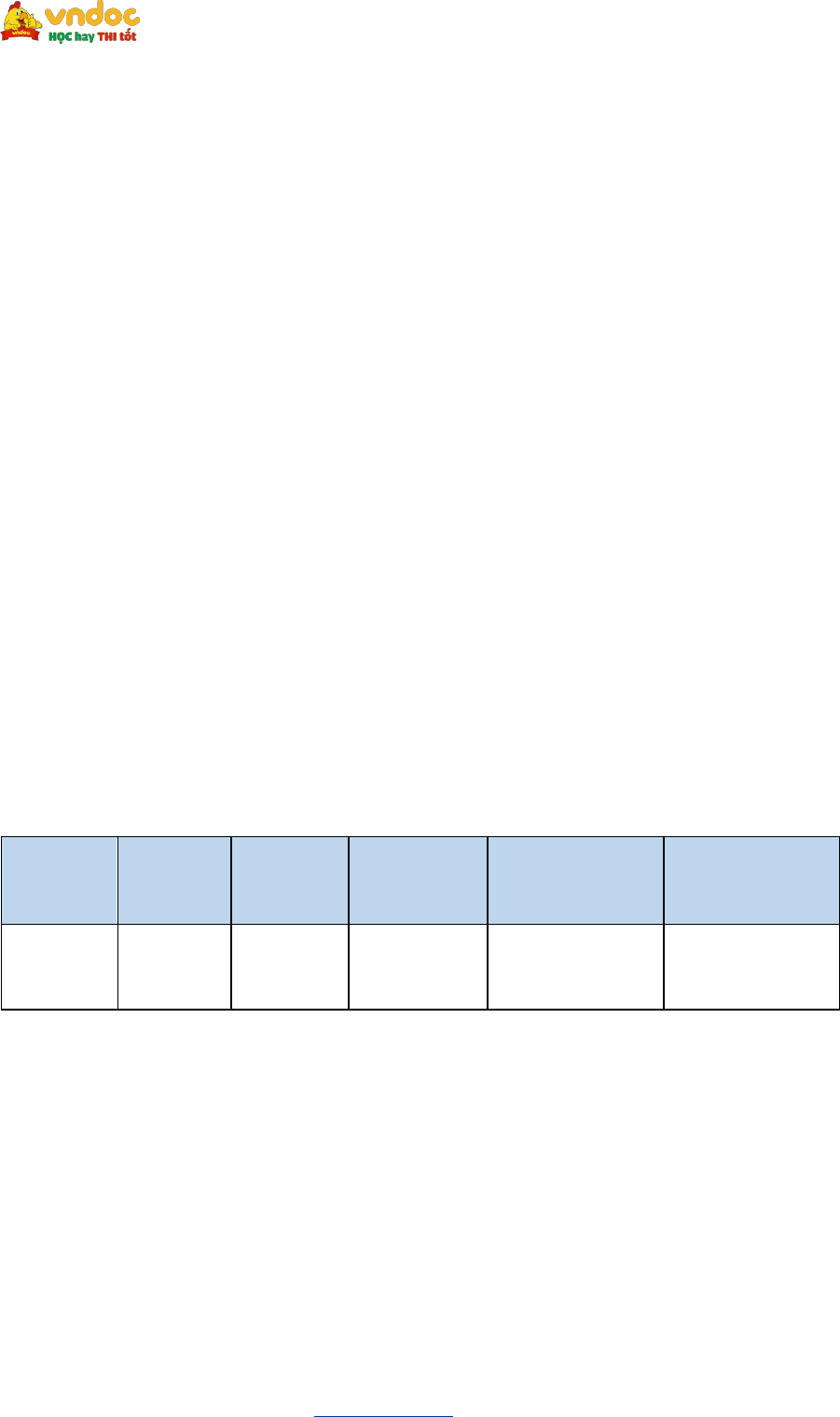
| Nguyên tử | Hydrogen | Oxygen | Kim loại kiềm (IA) | Kim loại kiểm thổ (IIA) | Aluminium |
| Số oxi hoá | +1 | -2 | +1 | +2 | +3 |
Quy tắc 3: Trong hợp chất, tổng số oxi hóa của các nguyên tử trong phân tử bằng 0.
Ví dụ:
Tổng số oxi hóa = (+4) + (-2).2 = 0.
Quy tắc 4: Trong ion đơn nguyên tử, số oxi hóa của nguyên tử bằng điện tích ion; trong ion đa nguyên tử, tổng số oxi hóa của các nguyên tử bằng điện tích ion.
Ví dụ:
Tổng số oxi hóa = (-3) + (+1).4 = + 1.
Trường hợp ngoại lệ: NaH , AlH (số oxi hóa của H là -1)
Số oxi hóa của O là: -2
Ví dụ: H2O, Na2O, SO2
Trường hợp ngoại lệ:
Số oxi hóa -1: H2O2, Na2O2
Số oxi hóa +2: OF2
II. Phương pháp và ví dụ về bài tập cân bằng phản ứng oxi hóa khử
1. Phương pháp cân bằng phản ứng oxi hóa khử
Nguyên tắc: Tổng số electron nhường = Tổng số electron nhận
Bước 1. Xác định số oxi hóa thay đổi thế nào.
Bước 2. Lập thăng bằng electron.
Bước 3. Đặt các hệ số tìm được vào phương trình phản ứng và tính các hệ số còn lại.
Lưu ý:
Ta có thể cân bằng phản ứng oxi hóa – khử theo phương pháp tăng – giảm số oxi hóa với nguyên tắc: tổng số oxi hóa tăng = tổng số oxi hóa giảm.
Phản ứng oxi hóa – khử còn có thể được cân bằng theo phương pháp ion–electron: ví dụ ...
Nếu trong một phương trình phản ứng oxi hóa – khử có nhiều nguyên tố có số oxi hóa cùng giảm (hoặc cùng tăng) mà:
+ Nếu chúng thuộc cũng một chất: thì phải đảm bảo tỉ lệ số nguyên tử của các nguyên tố trong phân tử.
+ Nếu chúng thuộc các chất khác nhau: thì phải đảm bảo tỉ lệ số mol của các chất đó theo đề đã cho.
* Trường hợp đối với hợp chất hữu cơ:
- Trong trường hợp mà hợp chất hữu cơ trước và sau phản ứng có một nhóm nguyên tử thay đổi và một số nhóm không đổi thì nên xác định số oxi hóa của C trong từng nhóm rồi mới cân bằng.
- Trong trường hợp mà hợp chất hữu cơ thay đổi toàn bộ phân tử, nên cân bằng theo số oxi hóa trung bình của C.
2. Ví dụ minh họa cân bằng phản ứng oxi hóa khử
Ví dụ 1. Lập phương trình hóa học của phản ứng Fe2O3 + CO → Fe + CO2 theo phương pháp thăng bằng electron.
Hướng dẫn cân bằng phản ứng
Bước 1: Fe+32O3 + C+2O → Fe0 + C+4O2
Chất oxi hóa là Fe2O3; chất khử là CO.
Bước 2:
Quá trình khử: 2Fe+3 + 6e→2Fe0
Quá trình oxi hóa: C+2 → C+4 + 2e
Bước 3:
|
1 x 3 x |
2Fe+3 + 6e→2Fe0 C+2 → C+4 + 2e |
Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số của các chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
Fe2O3 + 3CO → 2Fe + 3CO2
Ví dụ 2. Cân bằng phương trình hóa học của phản ứng sau theo phương pháp thăng bằng electron:
Cu + HNO3 → Cu(NO3)2 + NO + H2O.
Hướng dẫn cân bằng phản ứng
Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hóa, từ đó xác định chất oxi hóa, chất khử:
Cu0 + HN+5O3 → Cu+2(NO3)2 + N+2O + H2O
Cu: chất khử; HNO3: chất oxi hóa.
Bước 2: Biểu diễn quá trình oxi hóa, quá trình khử:
Quá trình khử: 2N+5 + 3e→N+2
Quá trình oxi hóa: Cu+0 → Cu+2 + 2e
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa dựa trên nguyên tắc: Tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận.
|
3 x 2 x |
Cu+0 → Cu+2 + 2e 2N+5 + 3e→N+2 |
Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số của các chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Ví dụ 4. Cân bằng phản ứng:
FeS + HNO3 → Fe(NO3)3 + N2O + H2SO4 + H2O
a. Xác định sự thay đổi số oxi hóa:
Fe+2 → Fe+3
S-2 → S+6
N+5 → N+1
(Viết số oxi hóa này phía trên các nguyên tố tương ứng)
b. Lập thăng bằng electron:
Fe+2 –> Fe+3 + 1e
S-2 –> S+6 + 8e
FeS –> Fe+3 + S+6 + 9e
2N+5 + 8e –> 2N+1
–> Có 8FeS và 9N2O.
c. Đặt các hệ số tìm được vào phản ứng và tính các hệ số còn lại:
8FeS + 42HNO3 → 8Fe(NO3)3 + 9N2O + 8H2SO4 + 13H2O
Ví dụ 5. Cân bằng phản ứng oxi hóa khử Fe + HNO3 → Fe(NO3)3 + NO2 ↑ + H2O
Bước 1: Xác định sự thay đổi số oxi hóa trước và sau phản ứng của các nguyên tử.
Chất khử: Fe
Chất oxi hóa: HNO3
Bước 2: Biểu diễn các quá trình oxi hóa, quá trình khử.
Quá trình oxi hóa:
Quá trình khử:
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa dựa trên nguyên tắc: Tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận.
|
x1 x3 |
|
Bước 4: Điền hệ số của các chất có mặt trong phương trình hoá học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
Fe + 6HNO3 → Fe(NO3)3 + 3NO2 ↑ + 3H2O
III. Bài tập cân bằng phản ứng oxi hóa khử và hướng dẫn giải
1. Câu hỏi bài tập tự luận phản ứng oxi hóa khử
a. Dạng đơn giản (trong phản ứng có một chất oxi hóa, một chất khử rõ ràng)
VD1: Cân bằng các phương trình phản ứng sau theo phương pháp thăng bằng electron.
1. Al + 6HNO3 → Al(NO3)3 + 3NO2 + 3H2O
1x (Al0 – 3e → Al+3)
3x (N+5 + 1e → N+4)
2. Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
1x (Al0 – 3e → Al+3)
1x (N+5 + 3e → N+2)
3. 8Al + 30HNO3 → 8Al(NO3)3 + 3N2O + 15H2O
8x (Al0 – 3e → Al+3)
3x (2N+5 + (2x4)e → 2N+1)
4. 10Al + 36HNO3 → 10Al(NO3)3 + 3N2 + 18H2O
10x (Al0 – 3e → Al+3)
3x (2N+5 + 10e → N20)
5. 8Al + 30HNO3 → 8Al(NO3)3 + 3NH4NO3 + 9H2O
8x (Al0 – 3e → Al+3)
3x (N+5 + 8e → N-3)
6. 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
3x (Cu0 – 2e → Cu+2)
2x (N+5 + 3e → N+2)
7. 2Fe + 6H2SO4 đặc → Fe2(SO4)3 + 3SO2 + 6H2O
1x (2Fe0 – 6e → 2Fe+3)
3x (S+6 + 2e → S+4)
8. 2Fe + 4H2SO4 đặc → Fe2(SO4)3 + S + 4H2O
1x (2Fe0 – 6e → 2Fe+3)
1x (S+6 + 6e → S0)
9. 8Fe + 15H2SO4 đặc → 4Fe2(SO4)3 + 3H2S + 12H2O
4x (2Fe0 – 6e → 2Fe+3)
3x (S+6 + 8e → S-2)
10. Cu + 2H2SO4 đặc → CuSO4 + SO2 + 2H2O
1x (Cu0 – 2e → Cu+2)
1x (S+6 + 2e → S+4)
11. 4Zn + 10HNO3 → 4Zn(NO3)2 + N2O + 5H2O
4x (Zn0 – 2e → Zn+2)
1x (2N+5 + 8e → 2N+1)
12. 4Mg + 10HNO3 → 4Mg(NO3)2 + NH4NO3 + 3H2O
4x (Mg0 – 2e → Mg+2)
1x (N+5 + 8e → N-3)
13. 3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O
3x (3Fe+8/3 – 3x1/3e → 3Fe+3)
1x (N+5 + 3e → N+2)
14. 3Na2SO3 + 2KMnO4 + H2O → 3Na2SO4 + 2MnO2 + 2KOH
3x (S+4 – 2e → S+6)
2x (Mn+7 + 3e → Mn+4)
15. K2Cr2O7 + 6FeSO4 + 7H2SO4 → K2SO4 + Cr2(SO4)3+ 3Fe2(SO4)3 + 7H2O
1x (2Cr+6 + 6e → 2Cr+3)
3x (2Fe+2 – 2e →2Fe+3)
b. Dạng phản ứng nội phân tử (phản ứng chỉ xảy ra trong một phân tử)
1. 2KClO3 →2KCl + 3O2
2x (Cl+5 + 6e → Cl-1)
3x (2O-2 – 4e → O20)
2. ? KMnO4 → K2MnO4 + MnO2 + O2
3. 2Cu(NO3)2 →2CuO + 4NO2 + O2
2x (2N+5 + 2e → 2N+4)
1x (2O-2 – 4e → O20)
? (NH4)2Cr2O7 → N2 + Cr2O3 + O2
c. Phản ứng tự oxi hóa khử (Sự tăng giảm số oxi hóa xảy ra chỉ trên 1 nguyên tố)
1. 2Cl2 + 4NaOH → 2NaCl + 2NaClO + 2H2O (cb sau đó tối giản)
1x (Cl20 + 2e → 2Cl-)
1x (Cl20 – 2e → 2Cl+1)
2. 3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O
5x (Cl20 + 2e → 2Cl-)
1x (Cl20 – 10e → 2Cl+5)
3. 4S + 6NaOH → 2Na2S + Na2S2O3 + 3H2O
2x (S0 + 2e → S-2)
1x (S0 – 4e → 2S+2)
4. ? K2MnO4 + H2O → KMnO4 + MnO2 + KOH
1x (Mn+6 + 2e → Mn+4)
2x (Mn+6 – 1e → Mn+7)
d. Phản ứng oxi hóa khử phức tạp
- Phản ứng oxi hóa khử có chứa hợp chất hữu cơ
CH3CH + KMnO4 + KOH → CH3COOK + K2CO3 + MnO2 + H2O
CH≡CH + KMnO4 + H2SO4 → H2C2O4 + MnO2 + KOH
CH3OH + KMnO4 + H2SO4 → HCOOH + MnSO4 + K2SO4 + H2O
- Phản ứng có sự thay đổi số oxi hóa của nhiều hơn hai nguyên tử
FeS2 + HNO3 → Fe(NO3)3 + H2SO4 + N2O + H2O
Cu2S + HNO3 → Cu(NO3)2 + CuSO4 + NO + H2O
CuFeS2 + O2 + Fe2(SO4)3 + H2O → CuSO4 + FeSO4 + H2SO4
2. Câu hỏi trắc nghiệm phản ứng oxi hóa khử
Câu 1. Cho phản ứng: FeSO4 + K2Cr2O7 + H2SO4 → Fe2(SO4)3 + K2SO4 + Cr2(SO4)2 + H2O. Cho biết hệ số cân bằng của FeSO4 và K2Cr2O7 lần lượt là bao nhiêu?
A. 5; 2
B. 6; 2
C. 6; 1
D. 8; 3
Câu 2. Cho phản ứng: Na2SO3 + KMnO4 + H2O → Na2SO4 + MnO2 + KOH
Hãy cho biết tỉ lệ hệ số của chất khử và chất oxi hóa sau khi cân bằng là đáp án nào dưới đây?
A. 4:3
B. 3:4
C. 3:2
D. 2:3
S(+4) → S(+6) + 2e
Mn(+7) + 3e → Mn(+4)
3Na2SO3 + 2KMnO4 + H2O → 3Na2SO4 + 2MnO2 + 2KOH
Câu 3. Trong phản ứng dưới đây, vai trò của H2S là:
2FeCl3 + H2S → 2FeCl2 + S + 2HCl
A. Chất oxi hóa.
B. chất khử.
C. Acid.
D. Vừa oxi hóa vừa khử.
Câu 4. Trong phản ứng nào dưới đây cacbon thể hiện đồng thời tính oxi hoá và tính khử?
A. C + 2H2 CH4
B. 3C + 4Al Al4C3
C. 3C + CaO CaC2 + CO
D. C + CO2 2CO
Câu 5. Trong phản ứng nào dưới đây HCl thể hiện tính oxi hoá?
A. HCl + AgNO3 → AgCl + HNO3
B. 2HCl + Mg → MgCl2 + H2
C. 8HCl + Fe3O4 → FeCl2 + 2FeCl3 + 4H2O
D. 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
Để xem toàn bộ 30 câu hỏi trắc nghiệm có đáp án, mời các bạn ấn link TẢI VỀ
.............................




