Iot
Chuyên đề Hóa học lớp 10: Iot được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Lý thuyết: Iot
I. Trạng thái tự nhiên
- So với các halogen khác, iot có trong vỏ trái đất ít nhất.
- Hợp chất iot có trong nước biển nhưng rất ít.
- Iot còn có trong tuyến giáp của người tuy nhỏ nhưng rất quan trọng vì nếu thiếu sẽ bị bệnh bướu cổ.
II. Tính chất
1. Tính chất vật lý
- Iot là tinh thể màu đen tím, có vẻ sáng kim loại.
- Hiện tượng thăng hoa:
+ Đun nóng, iot không nóng chảy mà biến thành thể hơi.
+ Làm lạnh, hơi iot chuyển thành tinh thể, không thông qua thể lỏng.
- Ít tan trong nước, tan nhiều trong dung môi hữu cơ.
2. Tính chất hóa học
a. Tác dụng với kim loại
- Iot oxi hóa được nhiều kim loại nhưng chỉ xảy ra khi đun nóng hoặc có xúc tác.
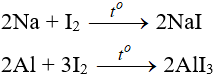
b. Tác dụng với hidro
H2 + I2 → 2HI phản ứng xảy ra thuận nghịch.
- Hidro Iotua dễ tan trong nước tạo thành dd axit Iothidric, đó là 1 axit rất mạnh, mạnh hơn cả axit clohidric, bromhidric.
- Iot hầu như không tác dụng với H2O.
c. Iot có tính oxi hóa kém clo và brom:
Cl2 + 2NaI → 2NaCl + I2
Br2 + 2NaI → 2NaBr + I2
d. Tính khử của axit HI
- HI có tính khử mạnh có thể khử được axit H2SO4 đặc.
8HI + H2SO4 → 4I2 + H2S + 4H2O
2HI + 2FeCl3 → FeCl2 + I2 + 2HCl
e. Tính chất đặc trưng của Iot
- Iot có tính chất đặc trưng là tác dụng với hồ tinh bột tạo thành hợp chất có màu xanh.
III. Ứng dụng, điều chế
1. Ứng dụng
- Dùng nhiều dưới dạng cồn iot (dd iot 5% trong ancol etylic) làm chất sát trùng.
- Có trong thành phần của nhiều dược phẩm.
- Trộn với lượng nhỏ KI và KIO3 thành muối iot giúp tránh các rối loạn do thiếu iot.
2. Điều chế
Cl2 + 2NaI → 2NaCl + I2
IV. Một số hợp chất của iot
1. Hidro iotua và axit iothidric
- HI kém bền với nhiệt, bị phân hủy thành I2 ở 300oC.
![]()
- Là axit mạnh, có tính khử mạnh:
8HI + H2SO4 → 4I2 + H2SO4 + 4H2O
2HI + 2FeCl3 → 2FeCl2 + I2 + 2HCl
2. Một số hợp chất khác
- Muối của axit iothidric đa số dễ tan trong nước.
- Một số muối iot không tan và có màu. Ví dụ: AgI màu vàng, PbI2 màu vàng.
- Ion iotua bị oxi hóa khi tác dụng với clo và brom:
2NaI + Cl2 → 2NaCl + I2
2NaI + Br2 → 2NaBr + I2
Trong phần chuyên đề trên đây chúng ta có thể hiểu biết thêm về Iot gồm các phản ứng hóa học, cấu hình nguyên tử, điều chế iot trong phòng thí nghiệm và thực tế...
Trên đây VnDoc đã giới thiệu tới các bạn lý thuyết Hóa học 10: Iot. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 10, Giải bài tập Hóa học lớp 10, Giải bài tập Vật Lí 10, Tài liệu học tập lớp 10 mà VnDoc tổng hợp và giới thiệu tới các bạn đọc.








