Trắc nghiệm chương 6: Nhóm Oxi, Lưu huỳnh phần 2
Chuyên đề Hóa học lớp 10: Trắc nghiệm chương 6: Nhóm Oxi, Lưu huỳnh phần 2 được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Bài tập trắc nghiệm chương 6
Bài 1: Cấu hình electron lớp ngoài cùng của các nguyên tử các nguyên tố nhóm VIA là
A. ns2np4. B. ns2np5. C. ns2np3. D. ns2np6.
Hướng dẫn giải:
Đáp án A.
Bài 2:Trong nhóm oxi, đi từ oxi đến telu. Phát biểu nào sau đây sai?
A. Bán kính nguyên tử tăng dần.
B. Độ âm điện của các nguyên tử giảm dần.
C. Tính bền của các hợp chất với hiđro tăng dần.
D. Tính axit của các hợp chất hiđroxit giảm dần.
Hướng dẫn giải:
Đáp án C.
Bài 3: Vị trí của nguyên tố Oxi trong bảng tuần hoàn hóa học là
A. Ô thứ 8, chu kì 3, nhóm VIA.
B. Ô thứ 8, chu kì 2, nhóm VIA.
C. Ô thứ 16, chu kì 3, nhóm VIA.
D. Ô thứ 16, chu kì 2, nhóm VIA.
Hướng dẫn giải:
Đáp án B.
Cấu hình của oxi: 1s22s22p4
Bài 4: Ion X2- có cấu hình electron lớp ngoài cùng là 2s22p6. X là nguyên tố nào sau đây?
A. Oxi. B. Lưu huỳnh. C. Clo. D. Flo.
Hướng dẫn giải:
Đáp án A.
Cấu hình của X: 1s22s22p4
Bài 5: Nguyên tử nguyên tố X có tổng số electron ở các phân lớp p là 10. Nguyên tố X là
A. Na. B. Cl. C. O. D. S.
Hướng dẫn giải:
Đáp án D.
Cấu hình của X: 1s22s22p63s23p4
Bài 6: Nguyên tố lưu huỳnh có Z = 16. Công thức oxit cao nhất của lưu huỳnh là
A. S2O5.B. SO4.C. SO2.D. SO3.
Hướng dẫn giải: Đáp án D.
Bài 7: Số oxi hóa có thể có của lưu huỳnh trong hợp chất là
A. 0, 2, 4, 6.
B. -2, 0, +4, +6.
C. 1, 3, 5, 7.
D. -2, +4, +6.
Hướng dẫn giải: Đáp án D.
Bài 8: Số oxi hoá của lưu huỳnh trong một loại hợp chất oleum H2S2O7 là
A. -2. B. +4. C. +6. D. +8.
Hướng dẫn giải:
Đáp án C.
(-1).2 + X.2 +(-2).7 = 0 ⇒ X = +6
Bài 9: Nhiệt phân hoàn toàn 31,6 gam KMnO4, thu được V lít O2 (đktc). Giá trị của V là
A. 2,24 B. 1,12 C. 4,48 D. 8,96
Hướng dẫn giải:
Đáp án A.
nKMnO4=0,2 mol
2KMnO4 → K2MnO4 + MnO2 + O2 ↑
0,2 0,1 (mol)
⇒ V = 0,1.22,4 = 2,24 (lít)
Bài 10: Có bao nhiêu gam SO2 hình thành khi cho 128 gam S phản ứng hoàn toàn với O2 dư?
A. 228 g B. 200 g C. 100 g D. 256 g
Hướng dẫn giải:
Đáp án D.
nS = 4 (mol)
S + O2 → SO2
4 4 (mol)
m = 4. (32+32) = 256 (g)
Bài 11: Phản ứng không xảy ra là
A. 2Mg + O2![]() 2MgO.
2MgO.
B. C2H5OH + 3O2![]() 2CO2 + 3H2O.
2CO2 + 3H2O.
C. 2Cl2 + 7O2![]() 2Cl2O7.
2Cl2O7.
D. 4P + 5O2![]() 2P2O5
2P2O5
Hướng dẫn giải: Đáp án C
Bài 12: Các khí có thể cùng tồn tại trong một hỗn hợp là
A. NH3 và HCl.
B. H2S và Cl2.
C. Cl2 và O2.
D. H2S và O2.
Hướng dẫn giải:
Đáp án C.
NH3 + HCl → NH4Cl
H2S + 4Cl2 + 4H2O → 8HCl + H2SO4
2H2S + O2 → 2S + 2H2O
Bài 13: Chất nào sau đây không phản ứng với O2 là
A. SO3. B. P. C. Ca. D. C
Hướng dẫn giải:
Đáp án A.
4P + 5O2 → 2P2O5
C + O2 → CO2
2Ca + O2 → 2CaO
Bài 14: Oxi tác dụng với tất cả các chất trong nhóm nào dưới đây?
A. Mg, Cl2.
B. Al, C.
C. Ca, F2.
D. Au, S.
Hướng dẫn giải:
Đáp án B.
Oxi không phản ứng với halogen và Au.
4Al + 3O2 → 2Al2O3
C + O2 → CO2
Bài 15: Đơn chất vừa có tính oxi hóa vừa có tính khử là
A. F2. B. O3. C. S. D. O2.
Hướng dẫn giải:
Đáp án C.
S + H2 → H2S
S + O2 → SO2
Bài 16: Cho 28,4 gam Na2SO4 tác dụng với lượng dư dung dịch BaCl2 thu được m gam kết tủa. Giá trị m:
A. 4,66g B. 46,6g C. 2,33g D. 23,3g
Hướng dẫn giải:
Đáp án B.
nNa2SO4=0,2 mol
Na2SO4 + BaCl2 → BaSO4 + 2NaCl
0,2 → 0,2 (mol)
mBaSO4=0,2.(137+32+16.4)=46,6 (g)
Bài 17: Cho 5,6 gam Fe tác dụng với dung dịch H2SO4 loãng, thể tích khí thoát ra ở đktc là:
A. 1,12 lít B. 5,6 lít C. 2,24 lít D. 3,36 lít
Hướng dẫn giải:
Đáp án C.
nFe = 0,1 (mol)
Fe + H2SO4 → FeSO4 + H2
0,1 0,1 (mol)
V = 0,1.22,4 = 2,24 (lít)
Bài 18: Câu nào sau đây đúng khi nói về tính chất hoá học của lưu huỳnh?
A. Lưu huỳnh không có tính oxi hoá, tính khử.
B. Lưu huỳnh chỉ có tính oxi hoá.
C. Lưu huỳnh có tính oxi hoá và tính khử.
D. Lưu huỳnh chỉ có tính khử.
Hướng dẫn giải:
Đáp án C.
S + H2 → H2S
S + O2 → SO2
Bài 19: Dãy gồm các chất đều tác dụng (trong điều kiện phản ứng thích hợp) với lưu huỳnh là
A. Hg, O2, HCl.
B. Pt, Cl2, KClO3.
C. Zn, O2, F2.
D. Na, Br2, H2SO4 loãng.
Hướng dẫn giải
Đáp án C.
Zn + S → ZnS
S + O2 → SO2
S + 3F2 → SF6
Bài 20: Kim loại nào sau đây tác dụng với lưu huỳnh ở nhiệt độ thường?
A. Al. B. Fe .C. Hg. D. Cu.
Hướng dẫn giải
Đáp án C.
Hg + S → HgS
Bài 21: Hiđro sunfua (H2S) là chất có
A. Tính axit mạnh.
B. Tính oxi hóa mạnh.
C. Vừa có tính axit, vừa có tính bazơ.
D. Tính khử mạnh.
Hướng dẫn giải Đáp án D
Bài 22: Thể tích dung dịch KOH 2M tối thiểu để hấp thụ hết 0,3 mol SO2 là:
A. 150ml B. 250ml C. 300ml D. 450ml
Hướng dẫn giải
Đáp án A.
KOH + SO2 → KHSO3
0,3 0,3
VKOH = n/CM = 0,3/2 = 0,15 lít
Bài 23: Sục 6,72 lít SO2 ở đktc vào dung dịch brom rồi cho dung dịch thu được tác dụng với BaCl2 dư, kết tủa thu được có khối lượng (g) là:
A. 23,3 B. 34,95 C. 46,6 D. 69,9
Hướng dẫn giải
Đáp án D.
Phương trình phản ứng
SO2 + Br2 + 2H2O → 2HBr + H2SO4
0,3 0,3 mol
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
0,3 0,3 mol
mBaSO4 = 0,3 × 233 = 69,9g
Bài 24: Dẫn a mol SO2 vào dung dịch chứa 1,5a mol KOH. Phát biểu nào sau đây đúng?
A Chỉ thu được muối axit
B. Chỉ thu được muối trung hòa
C. Thu được cả 2 muối
D. Thu được muối trung hòa và KOH dư.
Hướng dẫn giải
Đáp án C.
nKOH/nSO2=1,5a/a=1,5
Tạo 2 muối KHSO3 và K2SO3.
Bài 25: Cho FeS tác dụng với dung dịch HCl, khí bay ra là
A. H2S. B. Cl2. C. SO2. D. H2.
Hướng dẫn giải
Đáp án A.
FeS + 2HCl → FeCl2 + H2S
Bài 26: Lưu huỳnh trong chất nào sau đây chỉ có tính khử?
A. H2S. B. SO2. C. Na2S2O3. D. H2SO4.
Hướng dẫn giải
Đáp án A.
Bài 27: Đun nóng 11,2 gam Fe trong lưu huỳnh dư, khối lượng chất rắn thu được sau phản ứng là:
A. 8,8 gam B. 17,6 gam C. 4,4 gam D. 35,2 gam
Hướng dẫn giải
Đáp án B
nFe= 0,2 (mol)
Fe + S → FeS
0,2 0,2 (mol)
mFeS = 0,2 ( 56 + 32) = 17,6 (g)
Bài 28: Thêm từ từ dung dịch BaCl2 vào 300 ml dung dịch Na2SO4 1 M cho đến khi khối lượng kết tủa bắt đầu không đổi thì dừng lại, hết 50 ml. Nồng độ mol/l của dung dịch BaCl2 là:
A. 0,06M B. 6M C. 0,006M D. 0,6M
Hướng dẫn giải
Đáp án B.
nNa2SO4=0,3 mol
Na2SO4 + BaCl2 → BaSO4 + 2NaCl
0,3 0,3 (mol)
CBaCl2=n/V=0,3/0,05=6M.
Bài 29: Dãy nào sau đây đều có tính oxi hoá và khử?
A. O2; S; SO2.
B. S; SO2 ; Cl2.
C. O3; H2S; SO2.
D. H2SO4; S; Cl2.
Hướng dẫn giải Đáp án B.
Bài 30: Cho phản ứng hóa học: S + H2SO4 đặc![]() X + H2O. Vậy X là chất nào sau đây?
X + H2O. Vậy X là chất nào sau đây?
A. SO2. B. H2S. C. H2SO3. D. SO3.
Hướng dẫn giải
Đáp án A.
S + 2H2SO4 → 3SO2 + 2H2O
Bài 31: Muốn pha loãng dung dịch axit H2SO4 đặc cần làm như sau:
A. Rót từ từ dung dịch axit đặc vào nước.
B. Rót từ từ nước vào dung dịch axit đặc.
C. Rót nhanh dung dịch axit đặc vào nước.
D. Rót thật nhanh nước vào dung dịch axit đặc.
Hướng dẫn giải Đáp án A.
Bài 32: Hòa tan 12,8 gam Cu trong axit H2SO4 đặc, nóng dư. Thể tích khí SO2 thu được (đktc) là
A. 4,48 lít B. 2,24 lít C. 6,72 lít D. 8,96 lít
Đáp án A.
nCu = 0,2 (mol)
Bảo toàn electron: 2nSO2=2nCu
nSO2= 0,2 (mol) ⇒ V = 0,2.22,4 = 4,48 (lít)
Bài 33: Trung hòa 200ml dung dịch NaOH 2M bằng V (ml) dung dịch H2SO4 2M. Giá trị của V bằng
A. 200ml B. 0,2 ml C. 0,1 ml D. 100 ml
Hướng dẫn giải
Đáp án D
nNaOH = 2.0,2 = 0,4 (mol)
2NaOH + H2SO4 → Na2SO4 + 2H2O
0,4 0,2 (mol)
V=n/CM=0,2/2=0,1(l)=100ml
Bài 34: Cho 14,5g hỗn hợp Mg, Fe, Zn tác dụng hết với dung dịch H2SO4 loãng thấy thoát ra 6,72 lít H2 (đktc). Cô cạn dung dịch sau phản ứng được khối lượng muối khan tạo ra là:
A. 34,3 g B. 43,3 g C. 33,4 g D. 33,8 g
Hướng dẫn giải
Đáp án B
nH2SO4 =nH2=6,72/22,4=0,3 mol
mmuối = mKL + mgốc axit = 14,5 + 0,3.96 = 43,3 (g)
Bài 35: Để pha loãng H2SO4 đặc cách làm nào sau đây đúng?
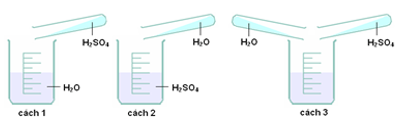
A. cách 1.
B. cách 2.
C. cách 3.
D. cách 1 và 2.
Hướng dẫn giải Đáp án A
Trên đây VnDoc đã giới thiệu tới các bạn lý thuyết Hóa học 10: Trắc nghiệm chương 6: Nhóm Oxi, Lưu huỳnh phần 2. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 10, Giải bài tập Hóa học lớp 10, Giải bài tập Vật Lí 10, Tài liệu học tập lớp 10 mà VnDoc tổng hợp và giới thiệu tới các bạn đọc.








