Hóa học 10 bài 30: Lưu huỳnh
Chuyên đề Hóa học lớp 10: Lưu huỳnh được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Lý thuyết: Lưu huỳnh
A/ Lý thuyết Hóa học 10 bài 29
I. Tính chất vật lí của lưu huỳnh
1. Hai dạng thù hình của lưu huỳnh
Lưu huỳnh có 2 dạng thù hình: lưu huỳnh tà phương (Sα) và lưu huỳnh đơn tà (Sβ).
Chúng khác nhau về cấu tạo tinh thể và 1 số tính chất vật lí nhưng có tính chất hóa học giống nhau.
Chúng biến đổi qua lại với nhau theo nhiệt độ.
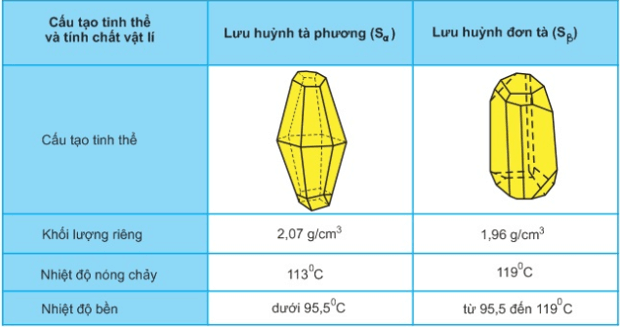
2. Ảnh hưởng của nhiệt độ đối với cấu tạo phân tử và tính chất vật lí của lưu huỳnh
- to < 113oC, Sα và Sβ là chất rắng, màu vàng. Phân tử gồm 8 nguyên tử liên kết cộng hóa trị với nhau thành mạch vòng.
to = 119oC, S nóng chảy thành chất lòng màu vàng, linh động. S8 mạch vòng.
- to = 187oC, S lỏng → quánh nhớt màu nâu đỏ.
- to = 445oC, S sôi → Sn bị đứt gãy thành nhiều phân tử nhỏ bay hơi.
Ở 1700oC hơi lưu huỳnh là những nguyên tử S.
II. Tính chất hóa học của lưu huỳnh
1. Tác dụng với kim loại và hidro
S thể hiện tính oxi hóa khi tác dụng với kim loại và hidro.
- Tác dụng với hiđro:
H2 + S → H2S (350oC)
- Tác dụng với kim loại (có to, tạo sản phẩm có số oxh thấp của kim loại).
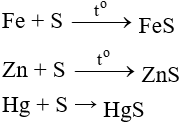 (Thủy phân sunfua, phản ứng xảy ra ở nhiệt độ thường nên thường dùng S khử độc Hg)
(Thủy phân sunfua, phản ứng xảy ra ở nhiệt độ thường nên thường dùng S khử độc Hg)
Chú ý: Một số muối sunfua có màu đặc trưng: CuS, PbS, Ag2S (màu đen); MnS (màu hồng); CdS (màu vàng) → thường được dùng để nhận biết gốc sunfua.
- Muối sunfua được chia thành 3 loại:
+ Loại 1. Tan trong nước gồm Na2S, K2S, CaS và BaS, (NH4)2S.
+ Loại 2. Không tan trong nước nhưng tan trong axit mạnh gồm FeS, ZnS, ...
+ Loại 3. Không tan trong nước và không tan trong axit gồm CuS, PbS, HgS, Ag2S, ...
2. Tác dụng với phi kim và hợp chất
S thể hiện tính khử khi tác dụng với 1 số phi kim và 1 số hợp chất có tính oxi hóa.
- Tác dụng với oxi:
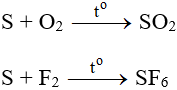
- Tác dụng với các chất có tính oxi hóa mạnh:
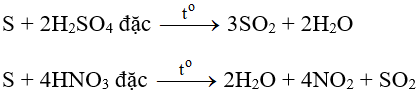
III. Ứng dụng
S là nguyên liệu quan trọng cho nhiều ngành công nghiệp.
- Điều chế H2SO4.
- Dùng để lưu hóa cao su, chế tạo diêm, sản xuất chất tẩy trắng bột giấy, chất dẻo ebonit, dược phẩm, phẩm nhuộm, chất trừ sâu, diệt nấm, ...
IV. Sản xuất
1. Khai thác lưu huỳnh
Sử dụng phương pháp Frasch để khai thác S tự do trong lòng đất.
2. Sản xuất lưu huỳnh từ hợp chất
- Đốt H2S trong điều kiện thiếu không khí.
2H2S + O2 → 2S + 2H2O
- Dùng H2S để khử SO2.
2H2S + SO2 → 3S + 2H2O
Phương pháp này giúp thu hồi trên 90% lượng S có trong các khí thải độc hại SO2 và H2S.
B/ Trắc nghiệm Hóa học 10 bài 30
Câu 1: Lưu huỳnh có các số oxi hóa nào sau đây?
A. -2; 0; -4; +4
B. 0; +4; -1; +6
C. 0; -1; -2; +6
D. -2; 0; +4; +6
Câu 2: Nguyên tố lưu huỳnh có số hiệu nguyên tử là 16. Vị trí của lưu huỳnh trong bảng tuần hoàn các nguyên tố hóa học là
A. Chu kì 3, nhóm VIA.
B. Chu kì 5, nhóm VIA.
C. Chu kì 3, nhóm IVA.
D. Chu kì 5, nhóm IVA.
Câu 3: Cho các phản ứng hóa học sau
- S + O2 ⟶t∘ SO2
- S + 3F2 ⟶t∘ SF6
- S + Hg → HgS
- S + 6HNO3 (đặc)⟶t∘ H2SO4 + 6NO2 + 2H2O
Trong các phản ứng trên, số phản ứng trong đó S thể hiện tính khử là
A. 3
B. 2
C. 4
D. 1
Câu 4: Hơi thủy ngân rất dộc, bởi vậy khi làm vỡ nhiệt kế thủy ngân thì chất bột được dùng để rắc lên thủy ngân rồi gom lại là
A. Vôi sống.
B. Cát.
C. Muối ăn.
D. lưu huỳnh.
Câu 5: Nguyên tử S đóng vai trò vừa là chất khử, vừa là chất oxi hóa trong phản ứng nào sau đây?
A. 4S + 6NaOH (đặc) ⟶t∘ 2Na2S + Na2S2O3 + 3H2O
B. S + 3F2 ⟶t∘ SF6
C. S + 6HNO3(đặc) ⟶t∘ H2SO2+ 6NO2+ 2H2O
D. S + 2Na ⟶t∘ Na2
Câu 6: Ứng dụng nào sau đây là ứng dụng chính của lưu huỳnh?
A. Chế tạo dược phẩm, phẩm nhuộm
B. Sản xuất H2SO4
C. Lưu hóa cao su
D. Chế tạo diêm, thuốc trừ sâu, diệt nấm
Câu 7: Đun nóng 4,8 gam bột Mg với 9,6 gam bột lưu huỳnh (trong điều kiện không có không khí), thu được chất rắn X. Cho toàn bộ X vào lượng dư dung dịch HCl, thu được V lít khí (đktc). Giá trị của V là
A. 2,24
B. 3,36
C. 4,48
D. 6,72
Câu 8: Cho 11 gam hỗn hợp bột sắt và bột nhôm tác dụng với bột lưu huỳnh trong điều kiện không có không khí) thấy có 12,8 gam lưu huỳnh tham gia phản ứng. Khối lượng sắt có trong 11 gam hỗn hợp đầu là
A. 5,6 gam.
B. 11,2 gam.
C. 2,8 gam.
D. 8,4 gam.
Câu 9: Phát biểu nào sau đây không đúng?
A. Lưu huỳnh là một phi kim mạnh, có tính oxi hóa mạnh điển hình
B. Khi tham gia phản ứng, lưu huỳnh thể hiện tính oxi hóa hoặc tính khử
C. Điều kiện thường, lưu huỳnh là chất rắn, màu vàng, không tan trong nước
D. Điều kiện thường, lưu huỳnh tồn tại dạng phân tử tám nguyên tử S8
Câu 10: Trong 5,6 gam bột sắt với 2,4 gam bột lưu huỳnh rồi nung nóng (trong điều kiện không có không khí), thu được hỗn hợp rắn M. Cho M tác dụng với lượng dư dung dịch HCl, giải phóng hỗn hợp khí X và còn lại một phần không tan G. Để đốt cháy hoàn toàn X và G cần vừa đủ V lít khí O2 (đktc). Giá trị của V là
A. 2,80
B. 3,36
C. 3,08
D. 4,48
Câu 11: Nung nóng hỗn hợp bột X gồm a mol Fe và b mol S trong khí trơ, hiệu suất phản ứng bằng 50%, thu được hỗn hợp rắn Y. Cho Y vào dung dịch HCl dư, sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Z có tỉ khối so với H2 bằng 5. Tỉ lệ a:b bằng
A. 2:1
B. 1:1
C. 3:1
D. 3:2
Câu 12: Đung nóng 9,75 gam kali với một phi kim X dư thu được 13,75 gam muối. Hỏi X là phi kim nào sau đây?
A. Cl
B. Br
C. S
D. N
Câu 13: Lưu huỳnh tác dụng với axit sunfuric đặc, nóng: S + 2H2SO4 → 3SO2 + 2H2O
Trong phản ứng này, tỉ lệ nguyên tử lưu huỳnh bị khử và số nguyên tử lưu huỳnh bị oxi hoá là
A. 1 : 2.
B. 1 : 3.
C. 3 : 1.
D. 2 : 1.
Câu 14: Cấu hình electron ở trạng thái kích thích của S khi tạo SO2 là
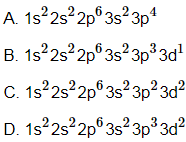
Câu 15: Tính chất vật lí nào sau đây không phải của lưu huỳnh
A. Chất rắn màu vàng, giòn
B. Không tan trong nước
C. Có tnc thấp hơn ts của nước
D. Tan nhiều trong benzen, ancol etylic
Đáp án
| 1D | 2A | 3A | 4D | 5A | 6B | 7C | 8A | 9A | 10A |
| 11A | 12C | 13A | 14B | 15D |
-----------------------------------
Trong phần chuyên đề trên đây chúng ta có thể hiểu biết thêm về Lưu huỳnh gồm các khái niệm về tính chất vật lý, các phản ứng hóa học, ứng dụng vào thực tế và cách điều chế lưu huỳnh
Như vậy VnDoc đã giới thiệu các bạn tài liệu Lý thuyết Hóa học lớp 10 bài 29: Lưu huỳnh. Mời các bạn tham khảo thêm tài liệu: Trắc nghiệm Sinh học 10, Giải bài tập Sinh học lớp 10, Giải Vở BT Sinh Học 10, Giải bài tập Sinh học 10 ngắn nhất, Tài liệu học tập lớp 10.
Để tiện trao đổi, chia sẻ kinh nghiệm về giảng dạy và học tập các môn học lớp 10, VnDoc mời các thầy cô giáo, các bậc phụ huynh và các bạn học sinh truy cập nhóm riêng dành cho lớp 10 sau: Nhóm Tài liệu học tập lớp 10. Rất mong nhận được sự ủng hộ của các thầy cô và các bạn.








