Hiệu suất phản ứng tổng hợp SO3, O3
Chuyên đề Hóa học lớp 10: Hiệu suất phản ứng tổng hợp SO3, O3 được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Bài tập Hiệu suất phản ứng tổng hợp SO3, O3
A. Phương pháp & ví dụ
1/ Lý thuyết và phương pháp giải
Trên thực tế hầu hết các phản ứng hóa học xảy ra không hoàn toàn, nghĩa là hiệu suất phản ứng (H%) dưới 100%.
Hiệu suất phản ứng được tính như sau:

Trừ trường hợp đề yêu cầu cụ thể tính hiệu suất phản ứng theo chất nào thì ta phải tính theo chất ấy. Còn khi ta biết lượng của nhiều chất tham gia phản ứng, để tính hiệu suất chung của phản ứng, ta phải:
So sánh tỉ lệ mol của các chất này theo đề cho và theo phản ứng.
- Nếu tỉ lệ mol so sánh là như nhau, thì hiệu suất phản ứng tính theo chất tham gia vào cũng cho cùng một kết quả.
- Nếu tỉ lệ mol so sánh là khác nhau, thì hiệu suất phản ứng không được tính theo chất luôn luônắn (ngay cả khi ta giả sử chất kia phản ứng hết).
2/ Ví dụ minh họa
Ví dụ 1: Trộn 3 mol SO2 với 2 mol O2, cho hỗn hợp vào bình kín có chứa sẵn chất xúc tác, bật tia lửa điện để phản ứng xảy ra. Sau phản ứng, đưa bình về điều kiện ban đầu thì thấy áp suất trong bình giảm đi 10%. Tính hiệu suất của phản ứng trên.
Hướng dẫn:
Gọi x là số mol oxi đã phản ứng, ta có:
Tổng số mol khí trước phản ứng là: 3 + 2 = 5 mol
Tổng số mol khí sau phản ứng là: 5 – x
Phản ứng: 2SO2 + O2 ↔ 2SO3
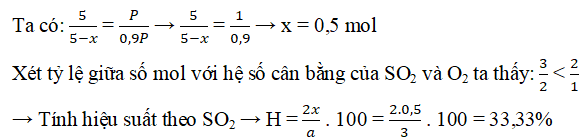
Ví dụ 2: Điều chế khí O2 , người ta nhiệt phân KClO3 có xúc tác MnO2. Nếu tiến hành nhiệt phân 4,9 gam KClO3 thì khối lượng oxi thu được là bao nhiêu? Biết hiệu suất phản ứng là 75%.
Hướng dẫn:
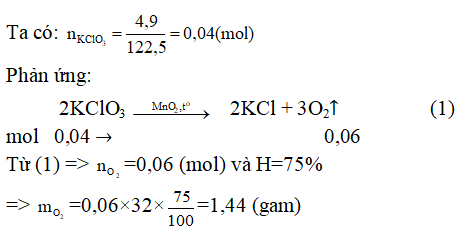
Ví dụ 3: Trong một bình kín dung tích không đổi chứa a mol O2 và 2a mol SO2 ở 100oC, 10atm (có mặt xúc tác V2O5). Nung nóng bình một thời gian, sau đó làm nguội bình tới 100oCC. Áp suất trong bình lúc đó là P. Thiết lập biểu thức tính Pp và tỉ khối (d) so với hiđro của hỗn hợp khí trong bình sau phản ứng theo hiệu suất phản ứng H. Hỏi P và d có giá trị trong khoảng nào?
Hướng dẫn:
Số mol hỗn hợp SO2 và O2: a + 2a = 3a (mol)
Phản ứng: 2SO2 + O2 → 2SO3
Số mol SO2 tham gia phản ứng: 2ah (mol)
Theo tỉ lệ phản ứng nhận thấy:
Cứ 2(mol) SO2 phản ứng,làm số mol hỗn hợp giảm 1 (mol)
Vậy khi 2ah (mol) SO2 phản ứng, làm số mol hỗn hợp giảm: ah (mol)
⇒ Số mol hỗn hợp sau phản ứng: 3a – ah = a(3 – h) (mol)
Áp dụng công thức: PV= nRT cho hỗn hợp ban đầu và hỗn hợp sau phản ứng, ta có: 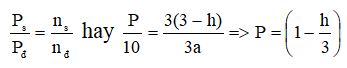
+) Khi h = 0 ⇒ P = 10 atm
+) Khi h = 1 ⇒ P = 20/3 atm
Do đó: 20/3 < P < 10
Khối lượng phân tử trung bình của hỗn hợp sau phản ứng:
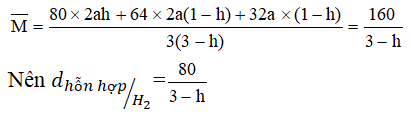
+) Khi h = 0 ⇒ d = 80/3
+) Khi h = 1 ⇒ d = 40
Vậy giới hạn của tỉ khối d: 80/3 < d < 40
Ví dụ 4: Một bình kín đựng oxi ở nhiệt độ toC có áp suất P1 (atm), sau khi phóng tia lửa điện để chuyển oxi thành ozon bình được đưa về nhiệt độ ban dầu, áp suất khí trong bình lúc này là P2. Tiếp tục dẫn khí trong bình qua dung dịch KI (dư) thu được dung dịch A và 2,2848 lít khí (đktc).
a, Tính hiệu suất của quá trình ozon hóa. Biết rằng để trung hòa dung dịch A cần dùng 150ml dung dịch H2SO4 0,08M.
b,Tính P2 theo P1.
Hướng dẫn:
a,Phương trình phản ứng:

b, Theo phương trình trạng thái khí lí tưởng. Nếu phản ứng xảy ra ở điều kiện nhiệt độ và thể tích không đổi thì ta có:
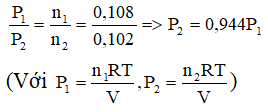
B. Bài tập trắc nghiệm
Câu 1. Trong một bình kín dung tích không đổi chứa a mol SO2, a mol O2 và một ít bột xúc tác V2O5, áp suất và nhiệt độ trong bình là P atm và toC. Nung nóng bình một thời gian, sau đó đưa nhiệt độ bình về toC, áp suất trong bình lúc này là P. Lập biểu thức P’ theo P và H (hiệu suất phản ứng). Hỏi P’ có giá trị trong khoảng nào? Biết ở toC các chất đều ở thể tích khí.
Đáp án:
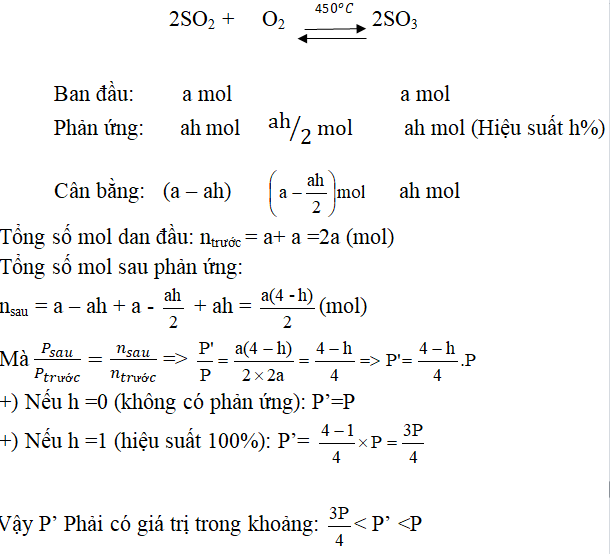
Câu 2. Trong một bình kín dung tích không đổi chứa a mol SO2 , a mol O2 và một ít bột xúc tác V2O5; áp suất và nhiệt độ trong bình là P atm và toC. Nung nóng bình một thời gian, sau đó đưa nhiệt độ bình về toC, áp suất trong bình lúc này là P’. Lập biểu thức P theo P và h (hiệu suất phản ứng). Hỏi P’ có giá trị trong khoảng nào, biết rằng ở toC các chất đều ở thế khí.
Đáp án:
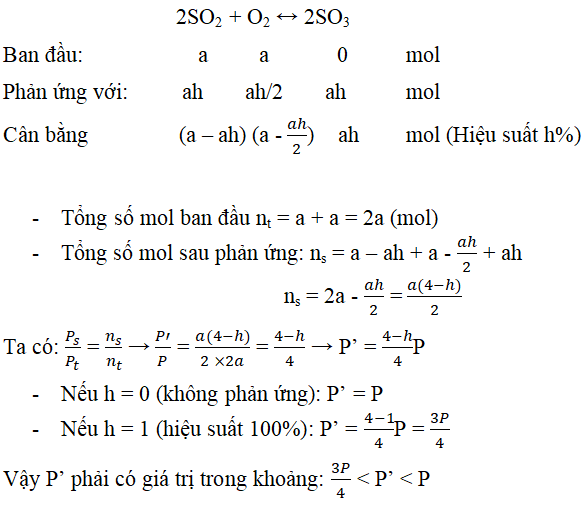
Câu 3. Từ 800 tấn quặng pirit sắt (FeS2) chứa 25% tạp chất không cháy, có thể sản xuất được bao nhiêu m3 dung dịch H2SO4 93% (D = 1,83 g/ml)? Giả thiết tỉ lệ hao hụt là 5%.
A. 473 m3 B. 547 m3 C. 324 m3 D. 284m3
Đáp án:
Phản ứng đốt cháy pirit sắt:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2↑
4 8 mol
Các phản ứng chuyển SO2 thành H2SO4
2SO2 + O2 → 2SO3
SO3 + H2O → H2SO4
Lượng FeS2 có trong 800 tấn quặng: 800 - (800. 0,25) = 600 tấn = 6.105 (kg)
Số mol FeS2 = 6.105/ 120 = 5.103 kmol
Số mol FeS2 thực tế chuyển thành SO2: 5.103 .95%= 4750 (kmol)
Theo các phương trình phản ứng ta có số mol SO2 bằng số mol H2SO4 và bằng 2 lần số mol FeS2 đã phản ứng: 4750.2 = 9500 (kmol)
Lượng H2SO4 được tạo thành: 98. 9500 = 931000(kg)
Thể tích của dung dịch H2SO4 93%: 931000/(1,83 ×0,93) = 547 m3
Câu 4. Đốt cháy hoàn toàn 80 gam pirit sắt trong không khí thu được chất rắn A và khí B. Lượng chất rắn A tác dụng vừa đủ với 200g H2SO4 29,4%. Độ nguyên chất của quặng là:
A. 60% B. 70% C. 80% D. 95%
Đáp án: A
Phương trình phản ứng
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
0,4 0,2 0,8 mol
nH2SO4 = (200 ×29,4)/(100×98) = 0,6 mol
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
0,2 0,6 mol
mFeS2 = 0,4 × 120 = 48g; %FeS2 = 48/80 × 100% = 60%
Câu 5. Nung nóng m gam PbS ngoài không khí sau một thời gian, thu được hỗn hợp rắn (có chứa một oxit) nặng 0,95 m gam. Phần trăm khối lượng PbS đã bị đốt cháy là
A. 74,69% B. 95,00% C. 25,31% D. 64,68%
Đáp án: A
m (g) 0,95m (g) → hh (PbO và PbS dư) + SO2
Áp dụng ĐLBTKH ta có:
mO = m – 0,95m = 0,05m (g) → nO = 3,125.10-3m (mol)
Ta có: nPbS phản ứng = nPbO = nO = 3,125.10-3m (mol)
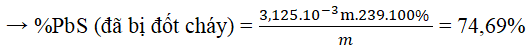
Câu 6. Trộn 3 mol SO2 với 2 mol O2, cho hỗn hợp vào bình xin có chứa sẵn chất xúc tác, bật tia lửa điện để phản ứng xảy ra. Sau phản ứng, đưa bình về điều kiện ban đầu thì thấy áp suất trong bình giảm đi 10%, Vậy hiệu suất của phản ứng trên là:
A. 90% B. 60,67% C. 33,33% D. 50,2%
Đáp án: C
Gọi x là số mol oxi đã phản ứng, ta có:
Tổng số mol khí trước phản ứng là: 3 + 2 = 5 mol
Tổng số mol khí sau phản ứng là: 5 – x
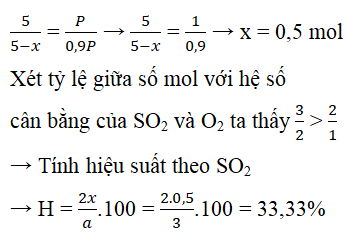
Trên đây VnDoc đã giới thiệu tới các bạn lý thuyết Hóa học 10: Hiệu suất phản ứng tổng hợp SO3, O3. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 10, Giải bài tập Hóa học lớp 10, Giải bài tập Vật Lí 10, Tài liệu học tập lớp 10 mà VnDoc tổng hợp và giới thiệu tới các bạn đọc.








