SO2 phản ứng với dung dịch kiềm
Chuyên đề Hóa học lớp 10: SO2 phản ứng với dung dịch kiềm được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Bài tập: SO2 phản ứng với dung dịch kiềm
A. Phương pháp & ví dụ
1/ Lý thuyết và phương pháp giải
Bài toán 1: SO2 + NaOH hoặc KOH
SO2 + NaOH → NaHSO3 (1)
SO2 + 2NaOH → Na2SO3 + H2O (2)
Lập tỉ lệ T = nNaOH / nSO2
T ≤ 1 → chỉ xảy ra phản ứng (1) tức tạo muối NaHSO3 (muối axit)
1 < T < 2 → xảy ra cả (1) và (2) tức tạo 2 muối NaHSO3 và Na2SO3
T ≥ 2 → chỉ xảy ra phản ứng (2) tức tạo muối Na2SO3 (muối trung hòa)
Bài toán 2: SO2 + Ba(OH)2 /Ca(OH)2
SO2 + Ba(OH)2 → BaSO3↓ + H2O (1)
2SO2 + Ba(OH)2 → Ba(HSO3)2 (2)
Lập tỉ lệ T = nSO2 / nBa(OH)2
T ≤ 1 → chỉ xảy ra phản ứng (1) tức tạo muối BaSO3 ↓
1 < T < 2 → xảy ra cả (1) và (2) tức tạo 2 muối BaSO3 ↓ và Ba(HSO3)2
T ≥ 2 → chỉ xảy ra phản ứng (2) tức tạo muối Ba(HSO3)2 (muối tan, không tạo kết tủa)
2/ Ví dụ minh họa
Ví dụ 1 : Hấp thụ 3,36 lít khí SO2 (đktc) vào 200 ml dung dịch NaOH aM. Tính a biết sau phản ứng chỉ thu được muối trung hòa.
Hướng dẫn:
Vì đề cho chỉ tạo muối trung hòa nên chỉ xảy ra phản ứng
SO2 + 2NaOH → Na2SO3 + H2O
0,15 → 0,3
nSO2 = 0,15 mol , VNaOH = 200 ml = 0,2 lít
→ a = CMNaOH = 0,15/0,2 = 0,75M
Ví dụ 2: Hấp thụ hoàn toàn 12,8g SO2 vào 250 ml dung dịch NaOH 1M. Tính khối lượng muối tạo thành sau phản ứng.
Hướng dẫn:
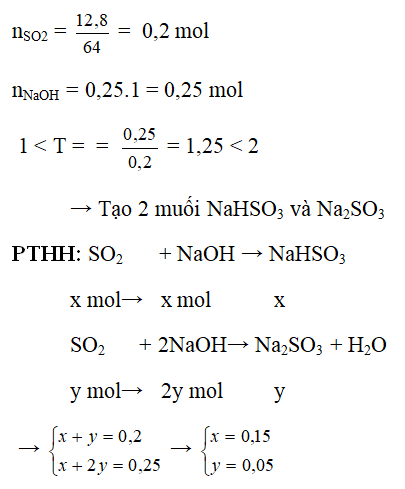
→ mNaHSO3 = 0,15. 104 = 15,6g
mNa2SO3 = 0,05 . 126 = 6,3g
Nhận xét : Có thể nhẩm nhanh trắc nghiệm: số mol 2 muối = số mol SO2
nNa2SO3 = nNaOH - nSO2 = 0,25 – 0,2 = 0,05 mol
nNaHSO3 = nSO2 - nNa2SO3 = 0,2 – 0,05 = 0,15 mol
Ví dụ 3: Hấp thụ 6,72 lít khí SO2 (đktc) vào 100 ml dung dịch Ba(OH)2 2M. Tính khối lượng muối thu được
Hướng dẫn:
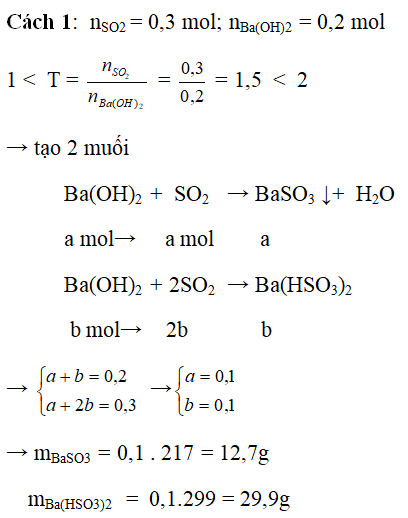
Cách 2: Ba(OH)2 + SO2 → BaSO3↓ + H2O
x mol → x mol → x mol
BaSO3 + SO2dư + H2O → Ba(HSO3)2
x mol → x mol
tạo kết tủa, khi dư SO2, kết tủa bị hòa tan, để hòa tan hết kết tủa nSO2 ít nhất = 2x= 2nBa(OH)2
Nếu lượng SO2 không đủ để hòa tan hết kết tủa, thì kết tủa chỉ bị tan một phần tức tồn tại 2 muối BaSO3 và Ba(HSO3)2
Ba(OH)2 + SO2 → BaSO3↓ + H2O
0,2 → 0,2 0,2
BaSO3 + SO2dư + H2O → Ba(HSO3)2
0,1 ← (0,3-0,2) → 0,1
nBaSO3 còn lại = 0,2 – 0,1 = 0,1 mol
Cách 3: Nhẩm trắc nghiệm: để hòa tan hết kết tủa nSO2 = 2nBa(OH)2, nếu lượng kết tủa chỉ bị tan một phần
nSO2 = 2nBa(OH)2 - nkết tủa (vì tỉ lệ số mol hòa tan kết tủa là 1:1)
→ nBaSO3 còn lại = 2nBa(OH)2 - nSO2 = 2.0,2 – 0,3 = 0,1 mol
Số mol 2 muối = số mol Ba(OH)2 → nBa(HSO3)2 = nBa(OH)2 - nBaSO3 còn lại = 0,2 – 0,1 = 0,1 mol
→ mBaSO3 = 0,1 . 217 = 12,7g
mBa(HSO3)2 = 0,1.299 = 29,9g
Ví dụ 4: Dẫn khí SO2 qua 200 ml dung dịch Ba(OH)2 aM thu được 21,7 g kết tủa, thêm tiếp dung dịch NaOH đến dư vào lại thu thêm 10,85 gam kết tủa nữa. Tính a
Hướng dẫn:
Thêm NaOH lại thu thêm kết tủa, chứng tỏ trong dung dịch tồn tại muối Ba(HSO3)2, mà vẫn có kết tủa
→ tồn tại 2 muối
n↓(1) = 21,7/217 = 0,1 mol
n↓(2) = 10,85/217 = 0,05 mol
Ba(OH)2 + SO2 → BaSO3 ↓+ H2O
0,1 0,1
Ba(OH)2 + 2SO2 → Ba(HSO3)2
0,05 ← 0,05
Ba(HSO3)2 + 2NaOH → BaSO3 ↓ + Na2SO3 + 2H2O
0,05 ← 0,05
nBa(OH)2 = 0,1 + 0,05 = 0,15 mol → a = = 0,75M
Cách 2: ∑n↓ = 0,1 + 0,05 = 0,15 mol
Ba(OH)2 → BaSO3
0,15 ← 0,15
→ a = 0,15/0,2 = 0,75M
B. Bài tập trắc nghiệm
Câu 1. Hấp thụ hoàn toàn 12,8g SO2 vào 250ml dung dịch NaOH 1M.
a) Viết phương trình hóa học của các phản ứng có thể xảy ra.
b) Tính khối lượng muối tạo thành sau phản ứng.
Đáp án:
nSO2 = 12,8/64 = 0,2 mol; nNaOH = 0,25.1 = 0,25 mol
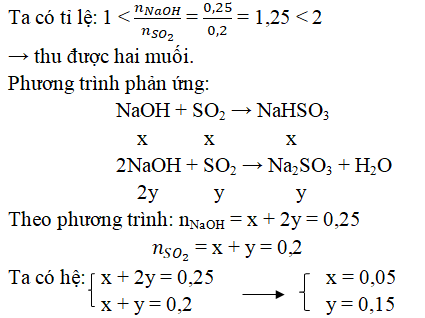
Khối lượng muối tạo thành sau phản ứng:
mNaHSO3 = 104.0,15 = 15,6g
mNa2SO3 = 126.0,05 = 6,3g
Câu 2. Dẫn V lít (đktc) khí SO2 vào 200 ml dung dịch KOH 1M thu được 12 gam muối KHSO3. Vậy V có giá trị là:
A. 2,24 lit B. 3,36 lít C. 4,48 lit D. 5,6 lit
Đáp án: B
Các phương trình phản ứng xảy ra:
SO2 + KOH → KHSO3
0,1 0,1 0,1 mol
SO2 + 2KOH → K2SO3 + H2O
0,05 0,1 mol
Tổng số mol SO2 = 0,15 mol
→ V = 3,36 lit
Câu 3. Dẫn 2,24 lít khí SO2 (đkc) vào 200 ml dung dịch KOH 1,5M vậy khi phản ứng xảy ra hoàn toàn thì thu được:
A. K2SO3 0,1M và KOH dư 0,4M B. KHSO3 0,1M
C. K2SO3 0,5M và KOH dư 0,5M D. KHSO3 0,1M và K2SO3 0,5M
Đáp án: C
Xét tỉ lệ: nSO2 = 0,1mol; nKOH = 0,3mol. Tỉ lệ nKOH : nSO2 = 3
Nên KOH dư → phản ứng chỉ tạo muối trung hòa
SO2 + 2KOH → K2SO3 + H2O
0,1 0,1
nK2SO3 = nSO2 =0,1 mol ⇒ CMK2SO3 = 0,1/0,2 = 0,5M
nKOH(dư) = 0,3 – 0,1.2 = 0,1 mol
⇒ CMK2SO3 = CMKOH sau pư = 0,1/0,2 = 0,5M
Câu 4. Thể tích dung dịch KOH 2M tối thiểu để hấp thụ hết 0,3 mol SO2 là:
A. 150ml B. 250ml C. 300ml D. 450ml
Đáp án:A
KOH + SO2 → KHSO3
0,3 0,3
VKOH = n/CM = 0,3/2 = 0,15 lít
Câu 5. Sục 6,72 lít SO2 ở đktc vào dung dịch brom rồi cho dung dịch thu được tác dụng với BaCl2 dư, kết tủa thu được có khối lượng (g) là:
A. 23,3 B. 34,95 C. 46,6 D. 69,9
Đáp án: D
Phương trình phản ứng
SO2 + Br2 + 2H2O → 2HBr + H2SO4
0,3 0,3 mol
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
0,3 0,3 mol
mBaSO4 = 0,3 × 233 = 69,9g
Câu 6. Hấp thụ hoàn toàn 1,344 lít CO2 (đktc) vào 13,95 ml dung dịch KOH 28% (d = 1,147 g/ml). Vậy muối thu được và nồng độ % tương ứng là:
A. K2SO3 10% C. K2SO3 15,93% và KHSO3 24,91%
B. KHSO3 15% D. KHSO3 24,19% và K2SO3 15,93%
Đáp án: D
nSO2= 0,06 mol
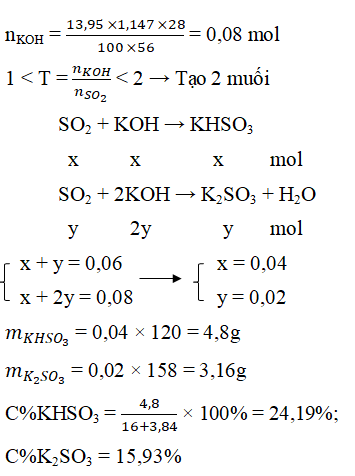
Câu 7. Dẫn a mol SO2 vào dung dịch chứa 1,5a mol KOH. Phát biểu nào sau đây đúng?
A Chỉ thu được muối axit
B. Chỉ thu được muối trung hòa
C. Thu được cả 2 muối
D. Thu được muối trung hòa và KOH dư.
Đáp án: C
Câu 8. Hấp thụ V lít SO2 (đktc) vào 300 ml dung dịch Ba(OH)2 1M thu được 21,7g kết tủa. Tính V
A. 2,24l B. 1,12 l C. 11,2 l D. A & C
Đáp án: D
Trường hợp 1: Ba(OH)2 dư, SO2 hết , nSO2 = nBaSO3
Ba(OH)2 + SO2 → BaSO3 ↓+ H2O
0,1 ← 0,1
→ VSO2 = 0,1. 22,4 = 2,24 lít
Trường hợp 2: Ba(OH)2 hết, SO2 dư nhưng không hòa tan hết kết tủa (kết tủa chỉ tan một phần)
Ba(OH)2 + SO2 → BaSO3 ↓+ H2O
0,1 0,1 ← 0,1
Ba(OH)2 + 2SO2 → Ba(HSO3)2
( 0,3 – 0,1)→ 0,4
→ nSO2 = 0,1 + 0,4 = 0,5 mol
→ VSO2 = 0,5. 22,4 = 11,2lít
(tính nhanh nSO2 = 2nBa(OH)2 - n↓ = 2. 0,3 – 0,1 = 0,5 mol)
Trên đây VnDoc đã giới thiệu tới các bạn lý thuyết Hóa học 10: SO2 phản ứng với dung dịch kiềm. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 10, Giải bài tập Hóa học lớp 10, Giải bài tập Vật Lí 10, Tài liệu học tập lớp 10 mà VnDoc tổng hợp và giới thiệu tới các bạn đọc.








