Bài tập Hóa học 10: Đồng vị (Có đáp án)
Đây là tài liệu Cao cấp - Chỉ dành cho Thành viên VnDoc ProPlus.
- Tải tất cả tài liệu lớp 10 (Trừ Giáo án, bài giảng)
- Trắc nghiệm không giới hạn
Bài tập đồng vị có đáp án
Bài tập Hóa học 10: Đồng vị tổng hợp các dạng bài tập về đồng vị cơ bản và nâng cao, giúp các em củng cố và nâng cao kiến thức về phần nguyên tử trong chương trình Hóa học lớp 10. Mời các em cùng tham khảo và làm bài.
A. KIẾN THỨC TRỌNG TÂM
Đồng vị là những nguyên tử có cùng số proton nhưng khác số notron, do đó số khối của chúng khác nhau.
Ví dụ: Nguyên tố O có 3 đồng vị là ![]()
Nguyên tử khối trung bình
Công thức: ![]() \(\overline A = \frac{{{A_1}.{x_1} + {A_2}.{x_2} + {A_3}.{x_3} + ....{A_n}.{x_n}}}{{100}}\)
\(\overline A = \frac{{{A_1}.{x_1} + {A_2}.{x_2} + {A_3}.{x_3} + ....{A_n}.{x_n}}}{{100}}\)
Trong đó A1, A2, A3,… là số khối của các đồng vị.
- x, y, z,… là thành phần % của các đồng vị.
DẠNG I. TÍNH % KHỐI LƯỢNG CỦA MỘT ĐỒNG VỊ TRONG PHÂN TỬ
1. Phương pháp giải
Hầu hết các nguyên tố có mặt trong tự nhiên là hỗn hợp các đồng vị bền
Áp dụng công thức: ![]() \(\overline A = \frac{{{A_1}.{x_1} + {A_2}.{x_2} + {A_3}.{x_3} + ....{A_n}.{x_n}}}{{100}}\)
\(\overline A = \frac{{{A_1}.{x_1} + {A_2}.{x_2} + {A_3}.{x_3} + ....{A_n}.{x_n}}}{{100}}\)
- Trong đó A1, A2, A3,… là số khối của các đồng vị.
- x1,x2,x3,… là thành phần % của các đồng vị.
Sử dụng sơ đồ đường chéo:
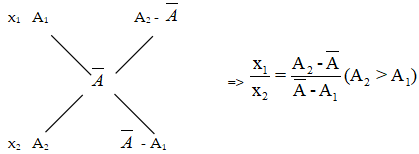
Ví dụ: Trong tự nhiên, nguyên tố copper (Cu) có hai đồng vị là ![]() . Nguyên tử khối trung bình của Copper (Cu) là 63,54. Thành phần phần trăm tổng số nguyên tử của đồng vị
. Nguyên tử khối trung bình của Copper (Cu) là 63,54. Thành phần phần trăm tổng số nguyên tử của đồng vị ![]() \(_{29}^{63}Cu\)là bao nhiêu?
\(_{29}^{63}Cu\)là bao nhiêu?
Hướng dẫn giải

2. Ví dụ minh họa
Ví dụ 1: Trong tự nhiên nguyên tố Bromine có 2 đồng vị, trong đó đồng vị ![]() \({}_{35}^{79}Br\)chiếm 54,5% về số lượng. Số khối của đồng vị còn lại là?
\({}_{35}^{79}Br\)chiếm 54,5% về số lượng. Số khối của đồng vị còn lại là?
Đáp án hướng dẫn giải bài tập
Đặt A2 là số khối của đồng vị thứ hai.
Phần trăm số lương của nó là: 100 - 54,5 = 45,5
Ta có:
![]() \(\overline M = \frac{{{A_1}.{x_1} + {A_2}.{x_2}}}{{100}} = \frac{{54,5.79 + {A_2}.45,5}}{{100}} = > {A_2} = 81\)
\(\overline M = \frac{{{A_1}.{x_1} + {A_2}.{x_2}}}{{100}} = \frac{{54,5.79 + {A_2}.45,5}}{{100}} = > {A_2} = 81\)
3. Bài tập vận dụng
Câu 1. Khối lượng nguyên tử của B bằng 10,81. B trong tự nhiên gồm hai đồng vị 10B và 11B. Hỏi có bao nhiêu phần trăm 11B trong Boric acid H3BO3. Cho H3BO3 = 61,81.
Đáp án hướng dẫn giải bài tập
Giả sử % của 10B và 11B trong tự nhiên lần lượt là x, y.
Ta có hệ phương trình:
 \(\begin{array}{l}
\left\{ \begin{array}{l}
10x + 11y = 10,81\\
x + y = 1
\end{array} \right. = > \left\{ \begin{array}{l}
x = 0,19\\
y = 0,81
\end{array} \right.\\
= > \% {}^{11}B = \frac{{0,81.11}}{{2 + 10,81 + 16.3}} \approx 14,42\%
\end{array}\)
\(\begin{array}{l}
\left\{ \begin{array}{l}
10x + 11y = 10,81\\
x + y = 1
\end{array} \right. = > \left\{ \begin{array}{l}
x = 0,19\\
y = 0,81
\end{array} \right.\\
= > \% {}^{11}B = \frac{{0,81.11}}{{2 + 10,81 + 16.3}} \approx 14,42\%
\end{array}\)
Câu 2. Trong tự nhiên đồng vị 37Cl chiếm 24,23,% số nguyên tử clo. Tính thành phần phần trăm về khối lượng 37Cl có trong HClO4 (với hydrogen là đồng vị 1H, oxygen là đồng vị 16O). Cho khối lượng nguyên tử trung bình của Clo là 35,5
Đáp án hướng dẫn giải bài tập
Đặt số mol HClO4 là 1 mol thì có 0,2423 mol 37Cl
![]() \(= > \% {}^{37}Cl = \frac{{37.0,2423}}{{1 + 35,5 + 16.4}}.100\% \approx 8,9205\%\)
\(= > \% {}^{37}Cl = \frac{{37.0,2423}}{{1 + 35,5 + 16.4}}.100\% \approx 8,9205\%\)
Câu 3. Trong tự nhiên Bromine có 2 đồng vị là 79Br và 81Br có nguyên tử khối trung bình là 79,92. Thành phần phần trăm về khối lượng của 81Br trong NaBr là bao nhiêu. Cho MNa = 23
Đáp án hướng dẫn giải bài tập
Gọi phần trằm đồng vị 79Br là a%
=> Phần trăm của đồng vị 81Br là 100% - a%
Nguyên tử khối trung bình của Br:
![]() \(= \frac{{79a.81(100 - a)}}{{100}}.100\% \approx 79,9 = > a = 54,5\)
\(= \frac{{79a.81(100 - a)}}{{100}}.100\% \approx 79,9 = > a = 54,5\)
Câu 4. Cho hợp chất XY2 tạo bởi hai nguyên tố X, Y. Y có hai đồng vị 79Y: chiếm 55% số nguyên tử Y và đồng vị 81Y. Trong XY2, phần trăm khối lượng của X là bằng 28,51%. Tính nguyên tử khối trung bình của X, Y.
Đáp án hướng dẫn giải bài tập
X = 63,73
Y = 79,
Giải thích các bước giải:
Phần trăm số nguyên tử của 81Y = 100%−55% = 45%
Suy ra, nguyên tử khối trung bình của Y là :
![]() \(\bar{M_{Y} }\)= 79.55% + 81.45% = 79,9
\(\bar{M_{Y} }\)= 79.55% + 81.45% = 79,9
Ta có :
% X= (X/X+2Y).100% = (X/X+79,9.2).100%= 28,51%
⇒ X = 63,73
Câu 5. Trong tự nhiên Cu có 2 đồng vị là là 63Cu và 65Cu. Khối lượng nguyên tử trung bình của Cu là 63,54. Thành phần phần trăm về khối lượng của là 63Cu trong CuCl2 là bao nhiêu (biết M Cl = 35,5)
Đáp án hướng dẫn giải bài tập
Giả sử % nguyên tử 65Cu và 63Cu trong tự nhiên lần lượt là x, y
Ta có hệ phương trình
![]() \(\left\{ \begin{array}{l}
x + y = 1\\
63x + 65y = 63,54
\end{array} \right. = > \left\{ \begin{array}{l}
x = 0,73\\
y = 0,27
\end{array} \right.\)
\(\left\{ \begin{array}{l}
x + y = 1\\
63x + 65y = 63,54
\end{array} \right. = > \left\{ \begin{array}{l}
x = 0,73\\
y = 0,27
\end{array} \right.\)
Phần trăm khối lượng của 63Cu trong CuCl2 là:
![]() \({\% ^{63}}Cu = \frac{{0,73.63}}{{63,54 + 35,5.2}} = 31,18\)
\({\% ^{63}}Cu = \frac{{0,73.63}}{{63,54 + 35,5.2}} = 31,18\)
Câu 6. Trong tự nhiên clo có hai đồng vị bền là 37Cl và 35Cl. Tính thành phần phần trăm về khối lượng 37Cl có trong KClO3 (với kiện là đồng vị 39K, oxygen là đồng vị 16O). Cho khối lượng nguyên tử trung bình của Chlorine là 35,5.
Đáp án hướng dẫn giải bài tập
Giả sử % nguyên tử 35Cl và 37Cl trong tự nhiên lần lượt là x, y.
![]() \(\left\{ \begin{array}{l}
x + y = 1\\
35x + 37y = 35,5
\end{array} \right. = > \left\{ \begin{array}{l}
x = 0,75\\
y = 0,25
\end{array} \right.\)
\(\left\{ \begin{array}{l}
x + y = 1\\
35x + 37y = 35,5
\end{array} \right. = > \left\{ \begin{array}{l}
x = 0,75\\
y = 0,25
\end{array} \right.\)
Phần trăm khối lượng của 37Cl trong KClO3 là:
![]() \({\% ^{37}}Cu = \frac{{0,25.37}}{{39 + 35,5 + 16.3}} = 7,55\%\)
\({\% ^{37}}Cu = \frac{{0,25.37}}{{39 + 35,5 + 16.3}} = 7,55\%\)
Câu 7. Trong tự nhiên silicon (Si) có 4 đồng vị với phần trăm số nguyên tử như bảng sau:
|
Đồng vị |
% số nguyên tử |
Nguyên tử khối |
|
28Si |
92,21 |
27,98 |
|
29Si |
4,70 |
28,98 |
|
30Si |
3,09 |
29,97 |
Tính nguyên tử khối trung bình của silicon
Đáp án hướng dẫn giải bài tập
Nguyên tử khối trung bình của silicon này (kết quả tính đến hai chữ số thập phân) là:
![]() \({{\overline{A}}_{Si}}=\frac{92,21\%.27,98+4,7\%.28,98+3,09\%.29,97}{100}=28,09\)
\({{\overline{A}}_{Si}}=\frac{92,21\%.27,98+4,7\%.28,98+3,09\%.29,97}{100}=28,09\)
Câu 8. Krypton là một trong những khí hiếm được trong chiếu sáng và nhiếp ảnh. Ánh sáng của Krypton có nhiều dải phổ, do đó nó được sử dụng nhiều làm tia laser có mức năng lượng cao. Hình dưới đây biểu thị phổ khối của Krypton, quan sát ảnh và trả lời câu hỏi sau:
a) Krypton có bao nhiêu đồng vị bền? Viết kí hiệu nguyên tử cho từng đồng vị.
b) Xác định số hạt proton và neutron có trong từng đồng vị
c) Tính giá trị nguyên tử khối trung bình của Krypton.

Đáp án hướng dẫn giải bài tập
a) Có 6 đồng vị
b)
|
|
78Kr |
80Kr |
82Kr |
83Kr |
84Kr |
86Kr |
|
p |
36 |
36 |
36 |
36 |
36 |
36 |
|
n |
42 |
44 |
46 |
47 |
48 |
50 |
c) ![]() \({{\overline{A}}_{Kr}}=\frac{78.0,35+80.2,27+82.11,56+83.11,55+84.56,9+86.17,37}{100}=83,8889\)
\({{\overline{A}}_{Kr}}=\frac{78.0,35+80.2,27+82.11,56+83.11,55+84.56,9+86.17,37}{100}=83,8889\)
DẠNG II. TÍNH SỐ NGUYÊN TỬ CỦA ĐỒNG VỊ TRONG MỘT LƯỢNG CHẤT
1. Ví dụ minh họa
Ví dụ 2: Khối lượng nguyên tử trung bình cả Bo (B) là 10,812u. Số nguyên tử khi có 94 nguyên tử là bao nhiêu?
Đáp án hướng dẫn giải bài tập
 \(\begin{array}{l}
\overline M = \frac{{{A_1}.{x_1} + {A_2}.{x_2}}}{{100}} = \frac{{{A_1}.{x_1} + (100 - {x_1}).{A_2}}}{{100}}\\
= \frac{{{A_1}.{x_1} + (100 - {x_1}).11}}{{100}} = 10,812 = > {x_1} = 18,8\%
\end{array}\)
\(\begin{array}{l}
\overline M = \frac{{{A_1}.{x_1} + {A_2}.{x_2}}}{{100}} = \frac{{{A_1}.{x_1} + (100 - {x_1}).{A_2}}}{{100}}\\
= \frac{{{A_1}.{x_1} + (100 - {x_1}).11}}{{100}} = 10,812 = > {x_1} = 18,8\%
\end{array}\)
Suy ra phần trăm số lượng của ![]() \({}_5^{11}B\) là: 100% - 18,8% = 81,2%
\({}_5^{11}B\) là: 100% - 18,8% = 81,2%
Do đó, số nguyên tử ![]() \({}_5^{11}B\) khi có 94 nguyên tử là:
\({}_5^{11}B\) khi có 94 nguyên tử là:
94.81,2/18,8 = 406 nguyên tử
2. Bài tập vận dụng
Câu 10. Trong tự nhiên Cu có 2 đồng vị là 63Cu và 65Cu. Nguyên tử trung bình của Cu là 63,546. Số nguyên tử 63Cu có trong 31,773g Cu là bao nhiêu?
Đáp án hướng dẫn giải bài tập
Giả sử % của 63Cu và 65Cu trong tự nhiên lần lượt là x, y.
Ta có hệ phương trình:
 \(\begin{array}{l}
\left\{ \begin{array}{l}
63x + 65y = 63,5\\
x + y = 1
\end{array} \right. = > \left\{ \begin{array}{l}
x = 0,75\\
y = 0,25
\end{array} \right.\\
= > nCuS{O_4} = \frac{{16}}{{63,5 + 32 + 16.4}} \approx 0,100313mol
\end{array}\)
\(\begin{array}{l}
\left\{ \begin{array}{l}
63x + 65y = 63,5\\
x + y = 1
\end{array} \right. = > \left\{ \begin{array}{l}
x = 0,75\\
y = 0,25
\end{array} \right.\\
= > nCuS{O_4} = \frac{{16}}{{63,5 + 32 + 16.4}} \approx 0,100313mol
\end{array}\)
Câu 11. Trong tự nhiên Chlorine có 2 đồng vị là 35Cl và 37Cl có nguyên tử khối trung bình là 35,5. Tính số nguyên tử của đồng vị 37Cl, trong 3,65 g HCl (cho khối lượng mol của H = 1).
Đáp án hướng dẫn giải bài tập
Ta có tỉ lệ nguyên tử 35Cl:37Cl = 1,5:0,5 = 3:1
nHCl = 0,1 => nCl = 0,1
Số mol 37Cl = 0,1.1/(1+3) = 0,025
=> Số nguyên tử 37Cl = 0,025.6,02.1023
Số nguyên tử 37Cl = 0,025.6,02.1023 = 1,505.1022
Câu 12. Hydrogen có nguyên tử khối trung bình là 1,008. Hỏi có bao nhiêu nguyên tử của đồng vị 2H trong 9 gam nước (cho rằng trong nước chỉ có đồng vị 1H và 2H, cho MH2O = 18).
Đáp án hướng dẫn giải bài tập
1ml có khối lượng là 1gam. Số mol H2O = 1/18 = 0,056 mol
H2O -> 2H + O
Nên số mol H = 2.0056 = 0,112 mol. Số nguyên tử H là 0,122.6,023.1023
= 674576.1017
Gọi a, b tương ứng là tỉ lệ % của 1H và 2H
Ta có: a + 2b = 1,008
a + b = 1 => b = 0,008 (0,8%) =>a = (99,2%)
Câu 13. Hydrogen có nguyên tử khối trung bình là 1,008. Hỏi có bao nhiêu nguyên tử của đồng vị 2H trong 1 ml nước (cho rằng trong nước chỉ có đồng vị 1H và 2H, cho MH2O = 18).
Đáp án hướng dẫn giải bài tập
Gọi % đồng vị là a: ![]() \(\frac{{1.(100 - a) + 2a}}{{100}} = 1,008 = > a = 0,8\)=> a = 0,8; % là 0,8%
\(\frac{{1.(100 - a) + 2a}}{{100}} = 1,008 = > a = 0,8\)=> a = 0,8; % là 0,8%
m của 1ml H2O: 1 gam
MH2O = 16 + 2,016 = 18,016u
—> Khối lượng của 1 mol H2O là 18,016g.
Số nguyên tử H có trong 1ml H2O
![]() \(\frac{{1.6.1023.2}}{{1,8.0,16}} = 0,{666.10^{23}}\)nguyên tử = 666.1020 nguyên tử
\(\frac{{1.6.1023.2}}{{1,8.0,16}} = 0,{666.10^{23}}\)nguyên tử = 666.1020 nguyên tử
Số nguyên tử chiếm:
![]() \(\frac{{{{666.10}^{20}}.0,8}}{{100}} = 5,{325.10^{20}}\) nguyên tử.
\(\frac{{{{666.10}^{20}}.0,8}}{{100}} = 5,{325.10^{20}}\) nguyên tử.
B. BÀI TẬP TRẮC NGHIỆM
C. BÀI TẬP VẬN DỤNG LIÊN QUAN
Câu 1. Carbon có 2 đồng vị bền. Đồng vị thứ nhất có 6 proton, 7neutron, chiếm 1,11%. Đồng vị thứ hai có ít hơn đồng vị thứ nhất 1 neutron.
a. Viết kí hiệu nguyên tử C.
b. Tính nguyên tử khối trung bình của C.
Câu 2. Đồng có hai đồng vị bền. Đồng vị thứ 1 có 29p và 36n, chiếm 30,8%. Đồng vị thứ 2 có ít hơn đồng vị thứ nhất 2n. Tính nguyên tử khối trung bình của đồng.
Câu 3.
a. Nguyên tố X có 2 đồng vị . đồng vị X1 có tổng hạt là 92 trong đó hạt mang điện nhiều hơn hạt không mang điện là 24. Tính số hiệu nguyên tử và số khối của đồng vị này
b. Đồng vị X2 có số khối nhiếu X1 là 2 nơtron . Viết ký hiệu của đồng vị X2. Trong tự nhiên X1 chiếm 73%. Tính nguyên tử khối trung bình của X
Câu 4. Một nguyên tố X có hai đồng vị với tỉ lệ số nguyên tử là . Hạt nhân nguyên tử X có 35 proton. Trong nguyên tử của đồng vị thứ nhất có 44 neutron. Số neutron trong nguyên tử của đồng vị thứ hai nhiều hơn trong đồng vị thứ nhất là 2 neutron. Tính nguyên tử khối trung bình của nguyên tố X .
Câu 5. Nguyên tố A có hai đồng vị X và Y. Tỉ lệ số nguyên tử của X : Y là 45 : 455. Tổng số hạt trong nguyên tử của X bằng 32. X nhiều hơn Y là 2 nơtron. Trong Y số hạt mang điện gấp 2 lần số hạt không mang điện. Tính nguyên tử lượng trung bình của A.
Câu 6. Carbon tự nhiên là hỗn hợp của hai đồng vị 12C và 13C, trong đó đồng vị 12C chiếm 98,9%.
Biết rằng đồng vị 12C có nguyên tử khối bằng 13,0034, đồng vị 13C có nguyên tử khối bằng 12, nguyên tử khối trung bình của carbon là bao nhiêu.
Câu 7. Nguyên tố Mg có 3 loại đồng vị có số khối lần lượt là: 24, 25 và 26. Trong 5000 nguyên tử Mg thì có 3930 đồng vị 24, 505 đồng vị 25, còn lại là đồng vị 26. Hãy tính khối lượng nguyên tử trung bình của Mg
Câu 8. Hợp chất A có công thức hóa học là MX3, M là kim loại, X là phi kim, biết:
+ Trong A, tổng số hạt p, n, e là 196, số hạt mang điện nhiều hơn số hạt không mang điện là 60.
+ Số khối của X lớn hơn M là 8. Tổng số hạt trong X nhiều hơn trong M là 12.
Công thức hóa học của A là:
Câu 9. Một nguyên tố R có 3 đồng vị X, Y ,Z; biết tổng số các hạt cơ bản (n, p, e) trong 3 đồng vị bằng 129, số neutron đồng vị X hơn đồng vị Y một hạt. Đồng vị Z có số proton bằng số neutron. Số khối của X, Y, Z lần lượt là
Câu 10. Trong tự nhiên clo có 2 đồng vị là 35Cl và 37Cl. Nguyên tử khối trung bình của chlorine là 35,5. Thành phần % khối lượng của 37Cl trong KClO3 là (Cho: K = 39, O = 16)
Câu 11. Trong tự nhiên sắt gồm 4 đồng vị 54Fe chiếm 5,8%, 56Fe chiếm 91,72%, 57Fe chiếm 2,2% và 58Fe chiếm 0,28%. Brom là hỗn hợp hai đồng vị 79Br chiếm 50,69% và 81Br chiếm 49,31%. Thành phần % khối lượng của 56Fe trong FeBr3 là
Câu 12. Khối lượng nguyên tử trung bình của brom là 79,91. Brôm có hai đồng vị ,trong đó đồng vị 7935Br chiếm 54,5%.Tính khối lương nguyên tử của đồng vị thứ hai.
Câu 13. Cho 1 hỗn hợp gồm 2 đồng vị có số khối trung bình 31,1 và có tỉ lệ phần trăm các đồng vị lần lượt là 90% và 10%. Tổng số hạt trong hai đồng vị là 93. Tổng số hạt không mang điện bằng 0,55 lần tổng số hạt mang điện. Xác định số neutron của đồng vị có số khối lớn hơn là bao nhiêu?
Câu 14. Trong tự nhiên Chlorine có 2 đồng vị là 35 Cl và 37 Cl có nguyên tử khối trung bình là 35,5. Tính số nguyên tử của đồng vị 37 Cl, trong 3,65 g HCl (cho khối lượng mol của H = 1).
Câu 15. Cho hợp chất XY tạo bởi hai nguyên tố X và Y. Y có đồng vị ![]() \(^{79}Y\) chiếm 55% số nguyên tử Y và đồng vị
\(^{79}Y\) chiếm 55% số nguyên tử Y và đồng vị ![]() \(^{81}Y\) . Trong XY phần trăm khối lượng của X là bằng 28,51%. TÍnh nguyên tử khối trung bình của X, Y.
\(^{81}Y\) . Trong XY phần trăm khối lượng của X là bằng 28,51%. TÍnh nguyên tử khối trung bình của X, Y.
👉 Tải ngay file trắc nghiệm đồng vị – Hóa 10 kèm đáp án!
..............................










