Hoàn thành PTHH sau: Mg + HNO3?
Chúng tôi xin giới thiệu bài Hoàn thành PTHH sau: Mg + HNO3? được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Hoàn thành PTHH sau: Mg + HNO3?
Câu hỏi: Hoàn thành PTHH sau: Mg + HNO3?
Lời giải:
Phương trình hóa học như sau:
|
10HNO3 |
+ |
4Mg |
→ |
3H2O |
+ |
4Mg(NO3)2 |
+ |
NH4NO3 |
|
axit nitric |
|
magie |
|
nước |
|
magie nitrat |
|
amoni nitrat |
|
63 |
|
24 |
|
18 |
|
148 |
|
80 |
|
(dung dịch) |
|
(rắn) |
|
(lỏng) |
|
(rắn) |
|
(khí) |
- Điều kiện xảy ra phản ứng: không có
- Cách thực hiện: bỏ từ từ Mg vào dung dịch HNO3
- Hiện tượng nhận biết: Có khí thoát ra có mùi khai (NH4NO3)
I. Axit nitric HNO3 là gì?
Axit nitric HNO3 là hợp chất vô cơ có công thức hóa học HNO3. Axit nitric HNO3 thường được xem làm một dung dịch nitrat hidro hay còn được gọi là axit nitric khan. Loại axit này được hình thành trong tự nhiên, do trong những cơn mưa do sấm và sét tạo thành.
Nếu một dung dịch có hơn 86% axit nitric, nó được gọi là axit nitric bốc khói. Axit nitric bốc khói có đặc trưng axit nitric bốc khói trắng và axit nitric bốc khói đỏ, tùy thuộc vào số lượng nitơ đioxit hiện diện.
II. Tính chất vật lí
- Axit tinh khiết là chất lỏng; không màu; bốc khói mạnh trong không khí ẩm.
- Kém bền. Bị phân hủy chậm ngay trong điều kiện thường tạo dung dịch có màu vàng:
4HNO3 → 4NO2 + 2H2O + O2
=> phải đựng dung dịch HNO3 trong bình tối màu.
- Tan tốt trong nước.
III. Tính chất hóa học của Axit Nitric HNO3
Axit nitric là một dung dịch nitrat hidro và là một axit khan, một monoaxit mạnh với tính oxy hóa mạnh. Nó có thể nitrat hóa nhiều hợp chất vô cơ và có hằng số cân bằng axit (pKa) là −2. Bên cạnh đó thì axit nitric cũng là một monoproton chỉ có một sự phân ly nên khi ở trong dung dịch, nó bị điện ly hoàn toàn thành một proton hydrat (ion hidroni) và các ion nitrat NO3−.
HNO3 + H2O → H3O+ + NO3-
Axit nitric là một axit mạnh
- HNO3 có khả năng làm giấy quỳ chuyển thành màu đỏ.
- Tác dụng với oxit bazo, bazo mà khi ở trong oxit, bazo tương ứng, kim loại đã đạt hóa trị cao nhất để tạo thành muối và nước:
CuO + 2HNO3 → Cu(NO3)2 + H2O
Mg(OH)2 + 2HNO3 → Mg(NO3)2 + 2H2O
- Tác dụng với muối mà khi ở trong muối đó, kim loại đã đạt hóa trị cao nhất để tạo thành muối mới và axit mới:
CaCO3 + 2HNO3 → Ca(NO3 )2 + CO2 + H2O
Tính oxi hóa mạnh
Tác dụng với kim loại:
+ HNO3 phản ứng với hầu hết các kim loại (trừ Au và Pt) → muối nitrat + H2O + sản phẩm khử của N+5 (NO2, NO, N2O, N2 và NH4NO3).
- Chú ý: Sản phẩm khử của N+5 là tùy thuộc vào độ mạnh của kim loại và nồng độ của HNO3.
- Nếu dung dịch đặc → NO2.
- Nếu dung dịch loãng → NO (dung dịch axit càng loãng, kim loại càng mạnh thì N bị khử xuống mức càng sâu).
VD:
Cu + 4HNO3 đặc, nóng → Cu(NO3)2 + 2NO2 + 2H2O
Fe + 4HNO3 loãng → Fe(NO3)3 + NO + 2H2O
8Na + 10HNO3 loãng → 8NaNO3 + NH4NO3 + 3H2O
Lưu ý:
- Nếu cho Fe hoặc hỗn hợp Fe và Cu tác dụng với dung dịch HNO3 mà sau phản ứng còn dư kim loại → trong dung dịch Fe thu được chỉ ở dạng muối Fe2+.
- HNO3 đặc nguội thụ động hóa với Al, Fe, Cr.
Tác dụng với phi kim → NO2 + H2O + oxit của phi kim.
C + 4HNO3 đặc, nóng → CO2 + 4NO2 + 2H2O
S + 4HNO3 đặc, nóng → SO2 + 4NO2 + 2H2O
P + 5HNO3 đặc, nóng → H3PO4 + 5NO2 + H2O
Tác dụng với các chất khử khác: (oxit bazơ, bazơ và muối trong đó kim loại chưa có hóa trị cao nhất...).
4HNO3 đặc, nóng + FeO → Fe(NO3)3 + NO2 + 2H2O
4HNO3 đặc, nóng + FeCO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
IV. Ứng dụng của axit nitric
+ HNO3 được dùng để điều chế thuốc nổ
+ HNO3 được dùng trong sản xuất phân bón
+ HNO3 được dùng trong điều chế các muối nitrat trong phòng thí nghiệm
+ HNO3 được dùng phổ biến trong ngành xi mạ, luyện kim
+ HNO3 được dùng trong nhà máy để tẩy rửa các đường ống, tẩy rửa bề mặt kim loại
+ HNO3 được dùng để chế tạo thuốc nhuộm vải, len, sợi,…
+ HNO3 được dùng trong xử lý nước để loại bỏ một số tạp chất, cân bằng lại độ tiêu chuẩn của nước.
+ HNO3 được dùng làm chất khử màu và để phân biệt một số chất.
+ Ngoài ra còn dùng để điều chế và sản xuất ra các hóa chất khác.
V. Điều chế HNO3
Trong phòng thí nghiệm
- Axit HNO3 được điều chế bằng cách cho natri nitrat hoặc kali nitrat rắn tác dụng với axit H2SO4 đặc, nóng:
![]()
- Điện phân các muối nitrat của kim loại đứng sau H+ của nước (sau Al).
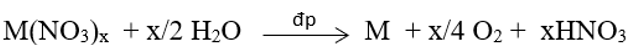
Trong công nghiệp
Được điều chế từ NH3 qua các giai đoạn:
NH3 → NO → NO2 → HNO3
+ GĐ 1: oxi hóa khí amoniac bằng oxi không khí ở nhiệt độ 850 − 900oC, có mặt chất xúc tác là platin:

+ GĐ 2: Oxi hóa NO thành NO2. Hỗn hợp chứa NO được làm nguội và cho hóa hợp với oxi không khí tạo thành khí nitơ đioxit:
2NO + O2 → 2NO2
+ GĐ 3: Chuyển hóa NO2 thành HNO3. Cho hỗn hợp nitơ đioxit vừa tạo thành và oxi tác dụng với nước, sẽ thu được dung dịch axit nitric:
4NO2 + 2H2O + O2 → 4HNO3
Dung dịch HNO3 thu được thường có nồng độ từ 52% đến 68%. Để có axit nitric với nồng độ cao hơn 68%, người ta chưng cất dung dịch HNO3 này với H2SO4 đậm đặc trong các thiết bị đặc biệt.
----------------------------------------
Trên đây VnDoc đã giới thiệu tới các bạn nội dung bài Hoàn thành PTHH sau: Mg + HNO3? Để có kết quả học tập tốt và hiệu quả hơn, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Hóa học 10, Chuyên đề Vật Lý 10, Chuyên đề Hóa học 10, Giải bài tập Toán 10. Tài liệu học tập lớp 10 mà VnDoc tổng hợp biên soạn và đăng tải.










