Nêu đặc điểm cấu tạo phân tử và tính chất vật lý của Hiđro clorua?
Nêu đặc điểm cấu tạo phân tử và tính chất vật lý của Hiđro clorua? được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Đặc điểm cấu tạo phân tử và tính chất vật lý của Hiđro clorua
Câu hỏi: Nêu đặc điểm cấu tạo phân tử và tính chất vật lý của Hiđro clorua?
Trả lời:
- Đặc điểm cấu tạo phân tử hiđro clorua
Hiđro clorua là hợp chất cộng hóa trị, phân tử có cực:
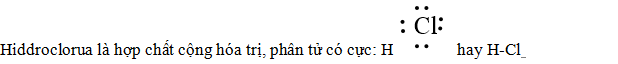
- Tính chất vật lý của hiđro clorua
+ Hiđro clorua là chất khí không màu, mùi xốc, độc.
+ Tỉ khối
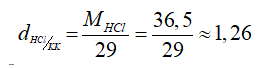
⟹ Nặng hơn không khí.
- Khí HCl tan rất nhiều trong nước (ở 20 độ C, một thể tích nước có thể hòa tan tới gần 500 thể tích HCl).
1. Axit Clohidric là gì?
Axit Clohidric là một hợp chất vô cơ có tính axit mạnh. Nó tồn tại ở 2 dạng đó là lỏng và khí. Axit Clohidric có công thức hóa học là HCL và có các tên gọi khác như Axit clohyđric, Axit hiđrocloric, Axit muriatic, Cloran.
Acid hydrochloric (tiếng Anh: Hydrochloric acid), hay còn gọi là acid muriatic, là một acid vô cơ mạnh, tạo ra từ sự hòa tan của khí hydro chloride (công thức hóa học: HCl) trong nước. Ban đầu, acid này được sản xuất từ acid sulfuric và muối ăn vào thời Phục Hưng, thậm chí từ thời Trung Cổ, sau đó được các nhà hóa học Glauber, Priestley và Davy sử dụng trong các nghiên cứu khoa học của họ. Acid hydrochloric được tìm thấy trong dịch vị, và cũng là một trong những yếu tố gây bệnh loét dạ dày khi hệ thống tự bảo vệ của dạ dày hoạt động không hiệu quả.
Acid hydrochloric đậm đặc nhất có nồng độ tối đa là 40%. Ở dạng đậm đặc, acid này có thể tạo thành các sương mù acid, chúng đều có khả năng ăn mòn các mô con người, gây tổn thương cơ quan hô hấp, mắt, da và ruột. Ở dạng loãng, acid hydrochloric cũng được sử dụng làm chất vệ sinh, lau chùi nhà cửa, sản xuất gelatin và các phụ gia thực phẩm, tẩy rửa, và xử lý da. Acid hydrochloric dạng hỗn hợp đẳng phí (gần 20,2%) có thể được dùng như một tiêu chuẩn cơ bản trong phân tích định lượng.
Axit HCl là một loại axit được sử dụng trong ngành công nghiệp dược phẩm, hóa học và trong xây dựng các chế phẩm, …
Tuy nhiên, HCl có khả năng ăn mòn các mô con người, gây tổn thương cơ quan hô hấp, mắt, da và ruột.
2. Tính chất vật lý của HCl
Ở dạng khí, axit clohydric không màu, mùi xốc nặng, tan trong nước, nặng hơn không khí, dễ bay hơi.
Ở dạng dung dịch, axit clohydric loãng.
Tan trong nước: 725 g/L ở 20°C.
Trọng lượng: 36,5 g/mol.
3. Tính chất hóa học của HCl
Theo Wikipedia, axit clohydric là một axit vô cơ mạnh, được tạo ra từ sự hòa tan trong nước của khí hydro clorua (HCl). Do vậy, nó mang đầy đủ tính chất hóa học của 1 axit mạnh. Cụ thể như sau:
+ Làm đổi màu quỳ tím
+ Là 1 chất điện ly mạnh
+ Tác dụng với kim loại, muối, bazo, oxit kim loại, các chất có tính oxy hóa cao
4. Ứng dụng phổ biến của Axit Clohidric trong đời sống
a, Trong xử lý nước bể bơi
Đây là loại hóa chất thường được sử dụng để xử lý các vấn đề thường gặp trong nước bể bơi như mất cân bằng nồng độ pH, nước bị vẩn đục, nhiều vi khuẩn gây hại.
Chuẩn bị dụng cụ:
+ Dụng cụ vệ sinh: bộ cặn hút bể bơi bao gồm sào nhôm, bàn hút, chổi cọ, ống mềm hút cặn, vợt vớt rác.
+ Hóa chất xử lý cần có: hóa chất HCl 32%, trợ lắng
+ Bộ test nước:để đo nồng độ pH và hàm lượng clo.
Các bước tiến hành:
Bước 1: Kiểm tra nồng độ hóa chất trong nước
Kiểm tra các chỉ tiêu pH và clo xem đã đảm bảo hay chưa (đối với pH từ 7.2 – 7.6, đối với Clo dư thì nồng độ dư lý tưởng là 0.6 – 1.5mg/l)
Bước 2: Thêm liều lượng để sốc Clo
– Biện pháp thủ công: Hòa tan Hcl với nước, tỷ lệ thường là 1 – 4 lít HCL cho 100m3 hồ bơi (tỷ lệ hóa chất sẽ phụ thuộc vào tình trạng nước thực tế) rồi rải xung quanh bể, khuấy đều. Sau khi xử lý khoảng từ 4 – 6 tiếng mới được phép đưa hồ bơi vào sử dụng trở lại.
– Sử dụng thiết bị: Thay vì tốn công, tốn sức ta dùng thiết bị châm hóa chất tự động Chemtrol 250 ORP/pH giúp ta kiểm soát dễ dàng liều lượng hóa chất khử trùng và điều chỉnh pH sao cho chuẩn xác.
Bước 3: Kiểm tra lại các thành phần hóa học trong nước. Nếu chưa đảm bảo cần tiến hành xử lý lại.
Trên đây là hướng dẫn xử lý nước bể bơi có pH cao hoặc thấp bằng Axit Clohydric 32%.
Các ứng dụng khác của Axit Clohidric
Tẩy gỉ thép bằng HCl nồng độ 18%
Fe2O3+Fe+6HCl ⇒ 3FeCl2 + 3H2O
Sản xuất hợp chất hữu cơ như vinyl clorua và diclorometan, PVC hoặc than hoạt tính:
2CH2=CH2 + 4HCl + O2 → 2ClCH2CH2Cl + 2H2O
gỗ + HCl + nhiệt → than hoạt tính
Kiểm soát và trung hòa pH, điều chỉnh tính bazo trong dung dịch
OH− + HCl → H2O + Cl−
Một số ứng dụng khác:
+ Để sản xuất các hợp chất vô cơ theo phản ứng axit – bazo, ứng dụng trọng quá trình xử lý nước thải, kẽm clorua cho công nghiệp mạ và sản xuất pin.
+ Ứng dụng khác như xử lý da, vệ sinh nhà cửa, và xây dựng nhà.
+ Trong khai thác dầu, HCl được dùng để bơm vào các tầng đá của giếng dầu với mục đích hòa tan 1 phần đá, tạo lỗ rỗng lớn hơn
+ Một số phản ứng hóa học liên quan đến axit HCl được ứng dụng trong sản xuất thực phẩm, phụ gia thực phẩm như aspartame, fructose, axit citric, lysine.
+ Dùng HCl trong sinh vật: Axit Clohidric chứa trong axit gastric được tiết ra từ dạ dày sẽ tạo môi trường axit trong dạ dày từ 1 – 2.
5. Tác hại của khí HCl đối với môi trường và con người
- Tiếp xúc nhiều với hơi axit clohydric có thể gây nhiễm độc, viêm dạ dày, viêm phế quản mãn tính, mẩn đỏ, tổn thương da hoặc bỏng nghiêm trọng, giảm thị lực,….
- Tiếp xúc lâu với khí HCl có thể gây khàn giọng, loét đường hô hấp, đau tức ngực, làm tê liệt các chức năng của hệ thần kinh trung ương,.…
- Gây bỏng, tụ máu, tích nước ở phổi nếu bị nặng,…
- Làm cây cối chậm phát triển, giảm độ mỡ nóng của lá cây, khiến các tế bào biểu bì của lá cây co lại,… thậm chí chết cây nếu tiếp xúc với HCl nồng độ cao.
----------------------------------------
Trên đây VnDoc đã giới thiệu tới các bạn nội dung bài Nêu đặc điểm cấu tạo phân tử và tính chất vật lý của Hiđro clorua? Để có kết quả học tập tốt và hiệu quả hơn, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Hóa học 10, Chuyên đề Vật Lý 10, Chuyên đề Hóa học 10, Giải bài tập Toán 10. Tài liệu học tập lớp 10 mà VnDoc tổng hợp biên soạn và đăng tải.










