Giải Hóa học 10 Chân trời sáng tạo bài 12
Chúng tôi xin giới thiệu bài Giải Hóa học 10 bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống được VnDoc biên soạn hướng dẫn bạn đọc trả lời các nội dung câu hỏi bài tập sách giáo khoa Hoá 10 Chân trời sáng tạo. Hy vọng thông qua nội dung tài liệu bạn đọc sẽ soạn bài chuẩn bị bài thật tốt, cũng như nắm được các phương pháp giải bài tập.
Bài: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
Giải hóa học 10 trang 72 Chân trời sáng tạo

Trong cuộc sống cũng như trong tự nhiên có nhiều hiện tượng mà nguyên nhân chính là do phản ứng oxi hóa – khử gây ra. Phản ứng oxi hóa – khử là gì? Vai trò quan trọng của chúng trong cuộc sống như thế nào?
Lời giải:
- Phản ứng oxi hóa – khử là phản ứng hóa học, trong đó có sự chuyển dịch electron giữa các chất phản ứng hay có sự thay đổi số oxi hóa của một số nguyên tử trong phản ứng. Trong phản ứng oxi hóa – khử luôn xảy ra đồng thời quá trình oxi hóa và quá trình khử
- Vai trò của phản ứng oxi hóa – khử trong đời sống
+ Là cơ sở của quá trình sản xuất trong các ngành công nghiệp nặng, sản xuất hóa chất cơ bản
+ Sản xuất phân bón
+ Sản xuất thuốc bảo vệ thực vật
+ Sản xuất dược phẩm
1. Số oxi hóa
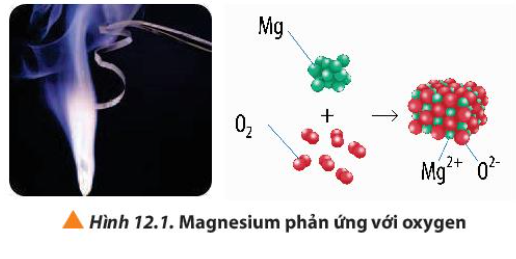
Phương pháp giải:
- O tham gia quá trình nhận electron
- Mg tham gia quá trình nhường electron
Lời giải:
- O tham gia quá trình nhận electron
O + 2e → O 2-
- Mg tham gia quá trình nhường electron
Mg → Mg 2+ + 2e
Phương pháp giải:
Trong phân tử HCl, mỗi nguyên tố bỏ ra 1 electron để góp chung tạo thành 1 cặp electron dùng chung
Lời giải:
- Trong phân tử HCl, mỗi nguyên tử bỏ ra 1 electron để góp chung tạo thành 1 cặp electron dùng chung
- Khi 1 cặp electron lệch hẳn về Cl
=> Có thể coi Cl nhận 1 electron và H nhường 1 electron
=> Cl sẽ mang điện tích -1 và H mang điện tích +1
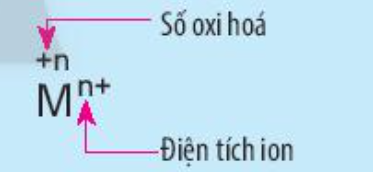
Phương pháp giải:
Quan sát hình vẽ và rút ra nhận xét
Lời giải:
- Kí hiệu số oxi hóa: Dấu rồi đến số (+n)
Ví dụ: +1, +2, -1, -2
- Kí hiệu điện tích ion: Số rồi đến dấu (n-). Với điện tích có giá trị là 1 thì không cần ghi số 1
Ví dụ: Cl - , O 2- , Na + , Ca 2+.
Phương pháp giải:
Quy tắc 4: Kim loại kiềm (nhóm IA) luôn có số oxi hóa +1, kim loại kiềm thổ (nhóm IIA) có số oxi hóa +2. Nhôm (aluminium) có số oxi hóa +3
Lời giải:
- Nguyên tử nhóm IA có 1 electron ở lớp ngoài cùng, có xu hướng nhường 1 electron để đạt cấu hình electron bền vững của khí hiếm => Sẽ có số oxi hóa là +1
- Nguyên tử nhóm IIA có 2 electron ở lớp ngoài cùng, có xu hướng nhường 2 electron để đạt cấu hình electron bền vững của khí hiếm => Sẽ có số oxi hóa là +2
- Nguyên tử nhóm IIIA có 3 electron ở lớp ngoài cùng, có xu hướng nhường 3 electron để đạt cấu hình electron bền vững của khí hiếm => Sẽ có số oxi hóa là +3
Phương pháp giải:
- Quy tắc 1: Số oxi hóa của nguyên tử trong các đơn chất = 0
- Quy tắc 2: Trong 1 phân tử, tổng số oxi hóa của các nguyên tử = 0
- Quy tắc 3: Trong các ion, số oxi hóa của nguyên tử (đối với ion đơn nguyên tử) hay tổng số oxi hóa các nguyên tử (đối với ion đa nguyên tử) = điện tích của ion đó
- Quy tắc 4: Trong hợp chất, H chủ yếu +1, O là -2, nhóm IA là +1, nhóm IIA là +2, Al là +3
Lời giải:
- Zn là đơn chất => Số oxi hóa của nguyên tử Zn là 0
- H 2 là đơn chất => Số oxi hóa của nguyên tử H trong H 2 là 0
- Cl - là ion đơn nguyên tử có điện tích là 1- => Số oxi hóa của ion Cltrong Cl - là -1
- O 2- là ion đơn nguyên tử có điện tích là 2- => Số oxi hóa của ion Otrong O 2- là -2
- S 2- là ion đơn nguyên tử có điện tích là 2- => Số oxi hóa của ion Strong S 2- là -2
- HSO 4-: gọi số oxi hóa của S trong ion là x.
Ta có: (+1).1 + x.1 + (-2).4 = -1
=> x = +6
Vậy số oxi hóa của H = +1, O = -2 và S = +6
- Na 2 S 2 O 3: gọi số oxi hóa của S trong phân tử là x
Ta có: (+1).2 + x.2 + (-2).3 = 0
=> x = +2
Vậy số oxi hóa của Na = +1, S = +2, O = -2
KNO 3: gọi số oxi hóa của N trong phân tử là x
Ta có: (+1).1 + x.1 + (-2).3 = 0
=> x = +5
Vậy số oxi hóa của K = +1, N = +5, O = -2

Phương pháp giải:
- Trong phân tử, tổng số oxi hóa của các nguyên tử = 0
- O trong hợp chất có số oxi hóa là -2
Lời giải:
- Gọi số oxi hóa của Fe trong hợp chất trên là x
Ta có: x.3 + (-2).4 = 0
=> x = +8/3
Vậy số oxi hóa của Fe trong Fe 3 O 4 = +8/3
2. Phản ứng oxi hóa - khử
Phương pháp giải:
- Chất khử là chất nhường electron để tạo thành ion mang điện tích dương
- Chất oxi hóa là chất nhận electron để tạo thành ion mang điện tích âm
Lời giải:
- Chất oxi hóa là chất nhận electron => Sau phản ứng, chất oxi hóa có số oxi hóa giảm so với trước phản ứng
- Chất khử là chất nhường electron => Sau phản ứng, chất khử có số oxi hóa tăng so với trước phản ứng
Luyện tập trang 75 Hóa học 10 : Cho phương trình hóa học của các phản ứng sau:
H2S + Br2 → 2HBr + S↓ (1)
2KClO3 2KCl + 3O2↑ (2)
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O (3)
Phản ứng nào là phản ứng oxi hóa – khử? Vì sao? Hãy xác định quá trình oxi hóa và quá trình khử của các phản ứng đó
Phương pháp giải:
- Phản ứng oxi hóa – khử là phản ứng hóa học, trong đó có sự chuyển dịch electron giữa các chất phản ứng hay có sự thay đổi số oxi hóa của một số nguyên tử trong phân tử
- Quá trình oxi hóa là quá trình nhường electron
- Quá trình khử là quá trình nhận electron
Lời giải:
- Xét phản ứng (1):
H2S−2 + Br20 → HBr−1+ S0↓
+ Là phản ứng oxi hóa – khử vì nguyên tử S và Br có sự thay đổi số oxi hóa
+ Quá trình oxi hóa: S-2 → S0 + 2e
+ Quá trình khử: Br20 + 2e → Br-1
- Xét phản ứng (2):
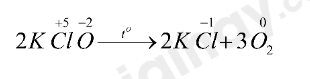
+ Là phản ứng oxi hóa – khử vì nguyên tử Cl và O có sự thay đổi số oxi hóa
+ Quá trình oxi hóa: 2O-2 → O20 + 4e
+ Quá trình khử: Cl+5 + 6e → Cl-1
- Xét phản ứng (3): CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
+ Không phải phản ứng oxi hóa – khử vì các nguyên tử không có sự thay đổi số oxi hóa
Câu hỏi 6 trang 76 Hóa học 10 : Làm thế nào để biết một phản ứng là phản ứng oxi hóa – khử?
Phương pháp giải:
Xác định số oxi hóa của các nguyên tố trước và sau phản ứng
Lời giải:
- Để nhận biết một phản ứng oxi hóa – khử, cần xác định số oxi hóa của các nguyên tố trước và sau phản ứng
- Phản ứng nào có các nguyên tố thay đổi số oxi hóa => Phản ứng oxi hóa – khử
3. Lập phương trình hóa học của phản ứng oxi hóa - khử
KMnO4 + HCl → KCl + MnCl2 + Cl2 ↑ + H2O (1)
NH3 + Br2 → N2 + HBr (2)
NH3+CuO→ Cu + N2 + H2O (3)
FeS2+O2→ Fe2O3+SO2(4)
KClO3→,MnO2KCl+O2↑(5)
Phương pháp giải:
- Nguyên tắc: Tổng số electron chất khử nhường = Tổng số electron chất oxi hóa nhận
Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng, từ đó xác định chất oxi hóa, chất khử
Bước 2: Viết quá trình oxi hóa và quá trình khử
Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khử nhường = tổng số electron chất oxi hóa nhận
Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại
Lời giải:
KMnO4+HCl→KCl+MnCl2+Cl2↑+H2O(1)
Bước 1: KMn+7O4+HCl−1→KCl+Mn+2Cl2+Cl20↑+H2O
Bước 2:
Quá trình oxi hóa: 2Cl-1 → Cl20 + 2e
Quá trình khử: Mn+7 + 5e → Mn+2
- KMnO4 là chất oxi hóa vì Mn trong KMnO4 nhận electron
- HCl là chất khử vì Cl trong HCl nhường electron
Bước 3: Xác định hệ số
|
5 x |
2Cl -1 → Cl 20 + 2e |
|
2 x |
Mn +7 + 5e → Mn +2 |
Bước 4: Đặt hệ số
2KMnO4+16HCl→2KCl+2MnCl2+5Cl2↑+8H2O
NH3+Br2→N2+HBr(2)
Bước 1: N−3H3+Br20→N20+HBr−1
Bước 2:
Quá trình oxi hóa: 2N-3 → N20 + 6e
Quá trình khử: Br20 + 2e → 2Br-
- Br 2 là chất oxi hóa vì Br nhận electron
- NH 3 là chất khử vì N trong NH 3 nhường electron
Bước 3: Xác định hệ số
|
1 x |
2N -3 → N 20 + 6e |
|
3 x |
Br 20 + 2e → 2Br - |
Bước 4: Đặt hệ số
2NH3+3Br2→N2+6HBr
NH3+CuO→Cu+N2+H2O(3)
Bước 1: N−3H3+Cu+2O→Cu0+N20+H2O
Bước 2:
Quá trình oxi hóa: 2N-3 → N20 + 6e
Quá trình khử: Cu+2 + 2e → Cu0
- CuO là chất oxi hóa vì Cu trong CuO nhận electron
- NH 3 là chất khử vì N trong NH 3 nhường electron
Bước 3: Xác định hệ số
|
1 x |
2N -3 → N 20 + 6e |
|
3 x |
Cu +2 + 2e → Cu 0 |
Bước 4: Đặt hệ số
2NH3+3CuO→3Cu+N2+3H2O
4. Ý nghĩa của phản ứng oxi hóa - khử
Phương pháp giải:
- Phản ứng đốt cháy gas: CH 4 + O 2 → CO 2 + H 2 O
- Phản ứng kích nổ hỗn hợp nhiên liệu: H 2 + O 2 → H 2 O
Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng, từ đó xác định chất oxi hóa, chất khử
Bước 2: Viết quá trình oxi hóa và quá trình khử
Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khử nhường = tổng số electron chất oxi hóa nhận
Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại
Phương pháp giải:
Phản ứng quang hợp:
CO2+H2O→C6H12O6+O2
Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng, từ đó xác định chất oxi hóa, chất khử
Bước 2: Viết quá trình oxi hóa và quá trình khử
Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khử nhường = tổng số electron chất oxi hóa nhận
Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại
Lời giải:
Bước 1: C+4O2+H2O−2→C60H12O6+O20
Bước 2:
Quá trình oxi hóa: 2O-2 → O20 + 4e
Quá trình khử: C+4 + 4e → C0
Bước 3: Xác định hệ số
|
1 x |
2O-2 → O20 + 4e |
|
1 x |
C +4 + 4e → C 0 |
Bước 4: Đặt hệ số
6CO2+6H2O→a/s,dlC6H12O6+6O2
- Vai trò của quá trình quang hợp của thực vật có vai trò:
+ Cung cấp oxygen, giảm lượng khí thải carbonic
+ Tổng hợp chất hữu cơ, đưa năng lượng mặt trời vào hệ sinh thái
Phương pháp giải:
Phản ứng luyện kim:
CO+Fe2O3→toFe+CO2
Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng, từ đó xác định chất oxi hóa, chất khử
Bước 2: Viết quá trình oxi hóa và quá trình khử
Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khử nhường = tổng số electron chất oxi hóa nhận
Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại
Lời giải:
Bước 1: C+2O+Fe2+3O3→toFe0+C+4O2
Bước 2:
Quá trình oxi hóa: C+2 → C+4 + 2e
Quá trình khử: Fe+3 + 3e → Fe0
Fe2O3 là chất oxi hóa vì Fe trong Fe2O3 nhận electron
CO là chất khử vì C trong CO nhường electron
Bước 3: Xác định hệ số
|
3 x |
C +2 → C +4 + 2e |
|
2 x |
Fe +3 + 3e → Fe 0 |
Bước 4: Đặt hệ số
3CO+Fe2O3→ 2Fe+3CO2
Phương pháp giải:
Phản ứng sinh ra dòng điện trong pin:
Zn+MnO2→kiemZnO+Mn2O3
Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng, từ đó xác định chất oxi hóa, chất khử
Bước 2: Viết quá trình oxi hóa và quá trình khử
Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khử nhường = tổng số electron chất oxi hóa nhận
Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại
Lời giải:
Bước 1: Zn0+Mn+4O2→Zn+2O+Mn2+3O3
Bước 2:
Quá trình oxi hóa: Zn0 → Zn+2 + 2e
Quá trình khử: Mn+4 + e → Mn+3
Bước 3: Xác định hệ số
|
1 x |
Zn 0 → Zn +2 + 2e |
|
2 x |
Mn +4 + e → Mn +3 |
Bước 4: Đặt hệ số
Zn+2MnO2→ZnO+Mn2O3
Phương pháp giải:
- Phản ứng đốt cháy methane tạo ra năng lượng
- Phản ứng hô hấp hiếu khí
- Phản ứng hô hấp kị khí
Lời giải:
- Phản ứng đốt cháy methane tạo ra năng lượng:
CH4 + 2O2 →CO2 + 2H2O + năng lượng
- Phản ứng hô hấp hiếu khí:
C6H12O6 + 6O2 → 6CO2 + 6H2O + 36 ATPs (năng lượng)
- Phản ứng hô hấp kị khí:
C6H12O6 → 2C2H5OH + 2CO2 + năng lượng
>>> Bài tiếp theo: Giải Hóa học 10 Chân trời sáng tạo bài 13
Như vậy, VnDoc đã gửi tới các bạn Giải Hóa học 10 bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống. Ngoài ra, các em học sinh có thể tham khảo môn Ngữ văn 10 Kết nối tri thức tập 1, Vật Lý 10 Kết nối tri thức và Toán 10 Kết nối tri thức tập 1, Toán 10 Kết nối tri thức tập 2, Sinh 10 Kết nối tri thức đầy đủ khác.










