Phương trình phản ứng: C2H4 + Br2
Chúng tôi xin giới thiệu bài Phương trình phản ứng: C2H4 + Br2 được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Phương trình hóa học
Phương trình hóa học:
CH2 = CH2 + Br2 → Br - CH2 - CH2 - Br
Etilen Brom Đi brommetan
C2H4 + Br2 → C2H4Br2
Điều kiện phản ứng: Không có
Hiện tượng nhận biết: Dung dịch Br2 bị mất màu
I. Etilen là gì?
Etilen hay Ethylene là một chất khí không màu với công thức hóa học C2H4 hoặc CH2=CH2. Đây là một trong các loại hidrocacbon và cũng là một alkene đơn giản nhất, đứng đầu trong dãy Anken.
II. Công thức cấu tạo của Etilen
- Etilen có công thức hóa học là C2H4, trong phân tử có một liên kết đôi giữa hai nguyên tử cacbon.
- Trong liên kết đôi lại có một liên kết kém bền và dễ bị đứt ra trong các phản ứng hóa học.
III. Tính chất vật lí của khí Etilen
Là chất khí không màu, không mùi, nhẹ hơn không khí, ít tan trong nước, dễ bắt cháy và có mùi ngọt nhẹ của xạ hương.
IV. Tính chất hóa học
- Trong phân tử etilen, mỗi nguyên tử cacbon liên kết với hai nguyên tử hiđro, hai hóa trị còn lại dùng để liên kết hai nguyên tử cacbon với nhau.
- Công thức cấu tạo của etilen:
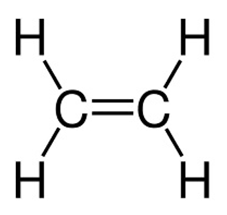
Viết gọn: CH2=CH2.
- Giữa hai nguyên tử cacbon có hai liên kết. Những liên kết như vậy được gọi là liên kết đôi. Trong liên kết đôi có một liên kết kém bền. Liên kết này dễ bị đứt ra trong các phản ứng hóa học.
Phản ứng cộng
- Phản ứng cộng halogen (phản ứng halogen hóa)
Cộng brom
- Dung dịch Brom hay nước Brom có màu vàng da cam; Ở phản ứng này, một liên kết kém bền trong liên kết đôi bị đứt ra và phân tử etilen kết hợp thêm một phân tử brom. Đây gọi là phản ứng cộng.
- Ngoài brom, trong những điều kiện thích hợp, etilen còn có phản ứng cộng với một số chất khác. Ví dụ hiđro, clo.
- Nhìn chung, các chất có liên kết đôi (tương tự như etilen) dễ tham gia phản ứng cộng.
- Cộng clo
- Phản ứng cộng hiđro (phản ứng hiđro hóa)
- Phản ứng cộng axit
- Hiđro halogenua (HCl, HBr, HI), axit sunfuric đậm đặc ,... có thể cộng vào etilen.
CH2=CH2 + HCl (khí ) → CH3CH2Cl: (etyl clorua)
CH2=CH2 + H-OSO3H → CH3CH2OSO3H: (etyl hiđrosunfat )
- Phản ứng cộng nước (phản ứng hiđrat hóa): Ở nhiệt độ thích hợp và có xúc tác axit, etilen có thể cộng nước.
Phản ứng trùng hợp
- Ở trong điều kiện thích hợp, liên kết kém bền trong phân tử etilen bị đứt ra dẫn đến hiện tượng các phân tử etilen kết hợp lại với nhau tạo ra một chất có phân tử lượng rất lớn được gọi là polime.
…+ CH2 = CH2 + CH2 = CH2 +… → … – CH2 – CH2 – CH2 – CH2 – …
- Phản ứng trên được gọi là phản ứng trùng hợp, polietilen (PE) là chất rắn, không độc, không tan trong nước và là nguyên liệu quan trọng trong công nghiệp chất dẻo.
Phản ứng oxi hóa
- Etilen cháy hoàn toàn tạo ra CO2, H2O và tỏa nhiều nhiệt:
C2H4 + 3O2 → 2CO2 + 2H2O
- Etilen làm mất màu dung dịch KMnO4:
2 CH2=CH2 + 2KMnO4 + 4H2O → + 2MnO2 + 2KOH (etylen glicol)
- Phản ứng làm mất màu dung dịch thuốc tím kali pemanganat được dùng để nhận ra sự có mặt của liên kết đôi của anken.
V. Ứng dụng của Ethylene
Trong công nghiệp
Trong ngành công nghiệp Ethylene được
- Dùng trong sản xuất bao bì.
- Vận chuyển.
- Ngành điện tử.
- Ngành dệt may.
- Nguyên liệu tạo ra chất phủ và chất kết dính.
- Nguyên liệu trong vật liệu xây dựng.
- Tham gia nhiều phản ứng tạo ra các hóa chất.
- Ứng dụng vào ngành hóa dầu.
- Ứng dụng dẫn xuất.
Đối với các ngành nông nghiệp:
- Ethylene có khả năng làm tăng sự sinh trưởng của các tế bào thực vật.
- Gây kích thích sự nảy mầm, sinh trưởng của các loại cây trồng, cây cối.
- Tăng năng suất cây trồng, phục vụ các ngành nông nghiệp trồng trọt canh tác.
- Đặc biệt quen thuộc nhất đối với chúng ta là làm cây trái quả nhanh chín hơn thậm chí còn chín đều, ổn định hơn so với các phương pháp khác.
VI. Ethylene C2H4 nguy hiểm thế nào?
- Etilen là một khí không độc nhưng có thể gây ngạt thở nếu môi trường chứa quá nhiều khí này và thiếu oxy.
- Nó là một chất khí không màu, không mùi nên rất khó để phân biệt việc khí ethylene có đang tích tụ trong phòng kín hay không.
- Hít quá nhiều khí ethylene gây ra hiện tượng mất nhận thức, gây mê thậm chí cả tử vong do ngạt thở. Ngoài ra, nếu tiếp xúc nó ở dạng lỏng khi không có đồ bảo hộ sẽ gây tê và các mô phơi nhiễm sẽ bị đông cứng.
- Etilen rất dễ bắt cháy nên không được để khí này lọt ra ngoài nơi đang có lửa hay dùng đồ gây nổ, cháy trong môi trường có khí etilen.
- Các bình chứa etilen đều chứa áp lực cao, tránh trường hợp bình bị rò rỉ ra. Cần thường xuyên kiểm tra các bình chứa etilen.
----------------------------------------
Trên đây VnDoc đã giới thiệu tới các bạn nội dung bài Phương trình phản ứng: C2H4 + Br2. Để có kết quả học tập tốt và hiệu quả hơn, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Hóa học 10, Chuyên đề Vật Lý 10, Chuyên đề Hóa học 10, Giải bài tập Toán 10. Tài liệu học tập lớp 10 mà VnDoc tổng hợp biên soạn và đăng tải.









