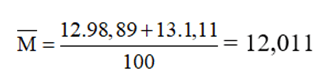Đồng vị là gì?
VnDoc xin giới thiệu bài Đồng vị là gì? được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Đồng vị
Câu hỏi: Đồng vị là gì?
Trả lời
Đồng vị là một trong hai hoặc nhiều loại nguyên tử của nguyên tố hóa học có cùng số hiệu nguyên tử và vị trí trong bảng tuần hoàn và hành vi hóa học gần giống nhau nhưng có khối lượng nguyên tử và tính chất vật lý khác nhau
1. Nguyên tử là gì?
+ Nguyên tử là hạt siêu nhỏ và trung hòa về điện.
+ Thành phần nguyên tử bao gồm hạt nhân nguyên tử (Proton và Notron) và vỏ nguyên tử (Electron).
+ Khối lượng của nguyên tử bằng khối lượng của hạt nhân nguyên tử.
2. Nguyên tố hóa học
Số điện tích hạt nhân (số proton, số electron) của những nguyên tử giống nhau thì được gọi là nguyên tố hóa học
Ví dụ: Số đơn vị điện tích hạt nhân của tất cả các nguyên tử là 17 thì là nguyên tố Clo
- Số hiệu nguyên tử của một nguyên tố là số đơn vị điện tích hạt nhân của nguyên tử đó. Số hiệu nguyên tử được kí hiệu là Z.
- Những đặc trưng cơ bản của nguyên tử bao gồm số khối và số đơn vị điện tích hạt nhân. Trong đó:
+ Nguyên tố được kí hiệu là X
+ Số hiệu nguyên tử được kí hiệu là Z (Z = số p = số e)
+ Số khối được kí hiệu là A (A = Z + N)
3. Lưu ý về đồng vị
Có các đồng vị bền và các đồng vị không bền. Hầu hết các đồng vị có số hiệu nguyên tử Z > 82 là không bền, chúng còn được gọi là các đồng vị phóng xạ.
4. Nguyên tử khối
Nguyên tử khối là khối lượng tương đối của nguyên tử.
Nguyên tử khối bằng số khối hạt nhân: M = A
Nguyên tử khối của một nguyên tử cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử.
Khối lượng của nguyên tử bằng tổng khối lượng của proton, nơtron và electron trong nguyên tử đó. Proton và nơtron đều có khối lượng xấp xỉ 1u còn electron có khối lượng nhỏ hơn rất nhiều, khoảng 0,00055u. Do đó, có thể coi nguyên tử khối xấp xỉ số khối của hạt nhân.
5. Nguyên tử khối trung bình
Nguyên tử khối trung bình của nguyên tố có nhiều đồng vị được tính bằng hệ thức:
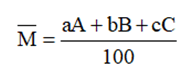
Với: a, b, c là số nguyên tử (hoặc % số nguyên tử) của mỗi đồng vị.
A, B, C là nguyên tử khối (hay số khối) của mỗi đồng vị.
Ví dụ: Nguyên tố Cacbon có 2 đồng vị bền 126C chiếm 98,89% và 136C chiếm 1,11%. Nguyên tử khối trung bình của cacbon là:
6. Câu hỏi trắc nghiệm
Câu 1: Có hai đồng vị bền của nguyên tố Cacbon. Chiếm 98,89% là 12C và chiếm 1,11% là 13C. Nguyên tố Cacbon có nguyên tử khối trung bình là:
- 12,5245
- 12,0111
- 12,0219
- 12,0525
Câu 2: Có ba đồng vị bền trong tự nhiên của Oxi đó là 160 chiếm x1%, 170 chiếm x2 và 180 chiếm 4%. Biết rằng Oxi có nguyên tử khối trung bình là 16,14. 160 và 170 lần lượt có phần trăm đồng vị là:
- 35% và 61%
- 80% và 16%
- 90% và 6%
- 25% và 71%
Câu 3: Có hai đồng vị X1 và X2 của một nguyên tố X. 18 là tổng số hạt của đồng vị X1 và 20 là tổng số hạt của đồng vị X2. Trong X, các phần trăm đồng vị bằng nhau và trong X1 các loại hạt cũng bằng nhau. X có nguyên tử khối trung bình là:
- 13
- 14
- 15
- 16
----------------------------------------
Trên đây VnDoc đã giới thiệu tới các bạn nội dung bài Đồng vị là gì? Để có kết quả học tập tốt và hiệu quả hơn, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Hóa học 10, Chuyên đề Vật Lý 10, Chuyên đề Hóa học 10, Giải bài tập Toán 10. Tài liệu học tập lớp 10 mà VnDoc tổng hợp biên soạn và đăng tải.