Giải Hóa 10 bài 8: Quy tắc Octet CTST
Giải Hóa 10 Chân trời sáng tạo Bài 8: Quy tắc Octet
Giải Hóa 10 bài 8: Quy tắc Octet CTST được VnDoc biên soạn hướng dẫn bạn đọc trả lời các nội dung câu hỏi thảo luận củng cố bài tập SGK Chân trời sáng tạo Hóa 10 bài 8. Mời các bạn tham khảo chi tiết.
>> Bài trước đó: Giải Hóa 10 Bài 7: Định luật tuần hoàn - Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học CTST
A. Nội dung câu hỏi thảo luận và củng cố
1. Liên kết hóa học
Câu 1 trang 52 Hóa 10 Chân trời sáng tạo
Hình 8.1 giải thích sự hình thành phân tử hydrogen (H2) và fluorine (F2) từ các nguyên tử. Theo em, các nguyên tử hydrogen và fluorine đã “bắt chước” cấu hình electron của các nguyên tử khí hiếm nào khi tham gia liên kết?
Hướng dẫn trả lời câu hỏi
Sự hình thành phân tử H2:

H H H2
Sau khi tham gia liên kết nguyên tử H: Có 1 lớp electron, 2 electron ở lớp ngoài cùng ⇒ Giống cấu hình electron của He
Sự hình thành phân tử F2

Sau khi hình thành liên kết Nguyên tử F: Có 2 lớp electron, 8 electron ở lớp ngoài cùng ⇒ Giống cấu hình electron của Ne
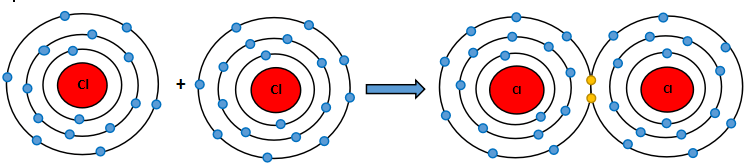
Câu 2 trang 52 Hóa 10 Chân trời sáng tạo
Sử dụng sơ đồ tương tự như Hình 8.1, hãy giải thích sự tạo thành phân tử chlorine (Cl2) và oxygen (O2) từ các nguyên tử tương ứng
Hướng dẫn trả lời câu hỏi
Nguyên tử chlorine có 7 electron ở lớp ngoài cùng. Khi 2 nguyên tử Cl liên kết với nhau, mỗi nguyên tử Cl sẽ góp 1 electron để tạo 1 cặp electron dùng chung tạo thành cấu hình electron bền vững của khí hiếm
Nguyên tử oxygen có 6 electron ở lớp ngoài cùng. Khi 2 nguyên tử O liên kết với nhau, mỗi nguyên tử O sẽ góp 2 electron để tạo 2 cặp electron dùng chung tạo thành cấu hình electron bền vững của khí hiếm
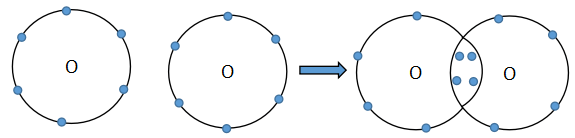
2. Quy tắc octet
Câu 3 trang 52 Hóa 10 Chân trời sáng tạo
Từ Hình 8.2, cho biết mỗi nguyên tử nitrogen đã đạt được cấu hình electron bền vững của nguyên tử khí hiếm nào.
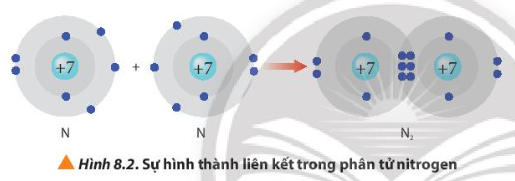
Hướng dẫn trả lời câu hỏi
Sau khi tham gia liên kết, mỗi nguyên tử nitrogen 8 electron ở lớp ngoài cùng và có 2 lớp electron
⇒ Đạt được cấu hình electron bền vững của nguyên tử khí hiếm neon

Luyện tập trang 53 Hóa 10 Chân trời sáng tạo
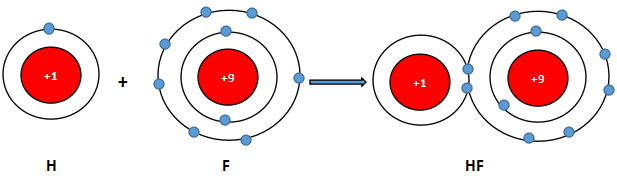
Nguyên tử của các nguyên tố hydrogen và fluorine có xu hướng cho đi, nhận thêm hay góp chung các electron hóa trị khi tham gia liên kết hình thành phân tử hydrogen fluoride (HF)?
Hướng dẫn trả lời câu hỏi
Nguyên tử fluorine và hydrogen đều là phi kim
+ Fluorine thuộc nhóm VIIA ⇒ có 7 electron lớp ngoài cùng.
+ Hydrogen thuộc nhóm IA ⇒ có 1 electron lớp ngoài cùng (lớp 1 có tối đa 2 electron)
⇒ Cả 2 có xu hướng nhận electron để đạt cấu hình electron của khí hiếm
⇒ Khi tham gia liên kết hình thành phân tử HF, mỗi nguyên tử sẽ gọp chung 1 electron để tạo thành cặp electron dùng chung.
Câu 4 trang 53 Hóa 10 Chân trời sáng tạo
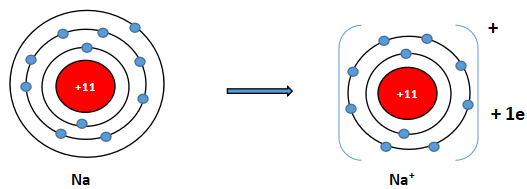
Ion sodium và ion fluoride có cấu hình electron của các khi hiếm tương ứng nào?
Hướng dẫn trả lời câu hỏi
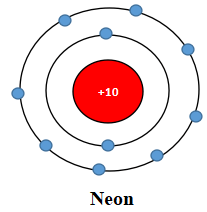
Ion sodium có 2 lớp electron và có 8 electron ở lớp ngoài cùng ⇒ Giống cấu hình electron của khí hiếm neon.
Ion fluoride có 2 lớp electron và có 8 electron ở lớp ngoài cùng ⇒ Giống cấu hình electron của khí hiếm neon.
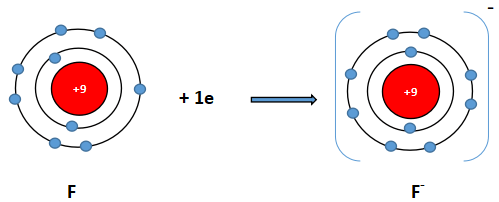
Cấu hình khí hiếm Neon

Câu hỏi 5 trang 54 Hóa 10 Chân trời sáng tạo
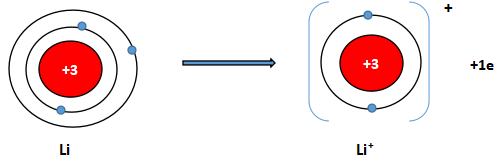
Trình bày sự hình thành ion lithium. Cho biết ion lithium có cấu hình electron của khí hiếm tương ứng nào?
Hướng dẫn trả lời câu hỏi
Lithium có số hiệu nguyên tử: Z = 3 ⇒ Cấu hình electron: 1s22s1
⇒ Lithium có xu hướng nhường 1 electron để đạt cấu hình electron bền vững của khí hiếm He. Phần tử thu được mang điện tích dương, gọi là ion lithium, kí hiệu Li.
Luyện tập trang 54 Hóa 10 Chân trời sáng tạo
Biết phân tử magnesium oxide hình thành bởi các ion Mg2+ và O2-. Vận dụng quy tắc octet, trình bày sự hình thành các ion trên từ những nguyên tử tương ứng.
Hướng dẫn trả lời câu hỏi
Nguyên tử Mg có Z = 12 ⇒ Cấu hình electron: 1s22s22p63s2
⇒ Nguyên tử Mg có 2 electron lớp ngoài cùng. Nguyên tử Mg sẽ nhường 2 electron tạo thành ion Mg2+ để đạt cấu hình electron bền vững của khí hiếm:

Nguyên tử O có Z = 8 ⇒ Cấu hình electron: 1s22s22p4
⇒ Nguyên tử O có 6 electron lớp ngoài cùng ⇒ Nguyên tử O sẽ nhận 2 electron tạo thành ion O2- để đạt cấu hình electron bền vững của khí hiếm:

B. Giải bài tập trang 54 SGK Hóa 10 Chân trời sáng tạo
Bài 1 trang 54 Hóa 10 CTST
Nguyên tử của nguyên tố nào sau đây có xu hướng đạt cấu hình electron bền vững của khí hiếm argon khi tham gia hình thành liên kết hóa học?
| A. Fluorine | B. Oxygen | C. Hydrogen | D. Chlorine |
Hướng dẫn giải bài tập
Đáp án D
Fluorine (Z = 9): 1s22s22p5
⇒ Có 7 electron lớp ngoài cùng. Có xu hướng nhận 1 electron thành F- có cấu hình: 1s22s22p6 giống với cấu hình khí hiếm Ne.
Oxygen (Z = 8): 1s22s22p4 ⇒ Có 6 electron lớp ngoài cùng ⇒ Có xu hướng nhận 2 electron thành O2- có cấu hình: 1s22s22p6 giống với cấu hình khí hiếm Ne.
Hydrogen (Z = 1): 1s1⇒ Có xu hướng góp chung 1 electron để tạo thành 1 cặp electron dùng chung đạt cấu hình: 1s2 giống với cấu hình khí hiếm He.
Chlorine (Z = 17): 1s22s22p63s23p5⇒ Có xu hướng nhận 1 electron thành Cl- có cấu hình: 1s22s22p63s23p6 giống với cấu hình khí hiếm Ar.
Vậy nguyên tử của nguyên tố chlorine có xu hướng đạt cấu hình electron bền vững của khí hiếm argon
Bài 2 trang 54 Hóa 10 CTST
Để đạt quy tắc octet, nguyên tử của nguyên tố potassium (Z = 19) phải nhường đi
| A. 2 electron | B. 3 electron | C. 1 electron | D. 4 electron |
Hướng dẫn giải bài tập
Đáp án C
Nguyên tử potassium có Z = 19
⇒ Cấu hình electron: 1s22s22p63s23p64s1
⇒ Có 1 electron lớp ngoài cùng ⇒ Có xu hướng nhường 1 electron để đạt cấu hình electron bền vững của khí hiếm Ar: 1s22s22p63s23p6
Bài 3 trang 54 Hóa 10 CTST
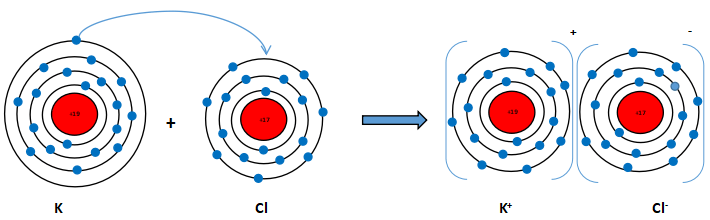
Vận dụng quy tắc octet, trình bày sơ đồ mô tả sự hình thành phân tử potassium
Hướng dẫn giải bài tập
Nguyên tử K (Z = 19): 1s22s22p63s23p64s1 ⇒ Có 1 electron lớp ngoài cùng ⇒ Có xu hướng nhường 1 electron này để đạt cấu hình electron giống khí hiếm.
Phần tử thu được mang điện tích dương, gọi là ion potassium, kí hiệu K+
Nguyên tử Cl (Z = 17): 1s22s22p63s23p5 ⇒ Có 7 electron lớp ngoài cùng ⇒ Có xu hướng nhận 1 electron từ nguyên tử K để đạt cấu hình electron giống khí hiếm.
Phần tử thu được mang điện tích âm, gọi là ion chlorine, kí hiệu, Cl-
Hai ion trái dấu hút nhau tạo thành phân tử potassium chloride (KCl)
Sơ đồ mô tả:
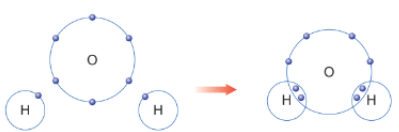
Bài 4 trang 54 Hóa 10 CTST
Giải thích sự hình thành liên kết trong phân tử H2O bằng cách áp dụng quy tắc
Hướng dẫn giải bài tập
Nguyên tử O (Z = 8): 1s22s22p4 ⇒ Có 6 electron lớp ngoài cùng ⇒ Có xu hướng nhận 2 electron để đạt được cấu hình electron giống khí hiếm.
Nguyên tử H (Z = 1): 1s1 ⇒ Có xu hướng nhận 1 electron để đạt được cấu hình electron giống khí hiếm.
⇒ Mỗi nguyên tử H sẽ góp chung 1 electron với nguyên tử O (góp chung 2 electron) tạo thành 2 cặp electron dùng chung
>> Bài tiếp theo: Giải Hóa 10 Bài 9: Liên kết ion
-----------------------------------------
Như vậy, VnDoc.com đã gửi tới các bạn Giải Hóa 10 bài 8: Quy tắc Octet CTST. Ngoài ra, các em học sinh có thể tham khảo môn Hóa 10 Cánh Diều, Lý 10 Cánh Diều và Toán 10 Chân trời sáng tạo tập 1, Sinh 10 Chân trời sáng tạo đầy đủ khác.
Hãy tham gia ngay chuyên mục Hỏi đáp các lớp của VnDoc. Đây là nơi kết nối học tập giữa các bạn học sinh với nhau, giúp nhau cùng tiến bộ trong học tập. Các bạn học sinh có thể đặt câu hỏi tại đây:
- Truy cập ngay: Hỏi - Đáp học tập
Hỏi đáp, thảo luận và giao lưu về Toán, Văn, Hóa, Lý, Sinh, Tiếng Anh,... từ Tiểu Học đến Trung học phổ thông nhanh nhất, chính xác nhất.








