Giải Hóa học 10 Cánh diều bài 14
Giải Hóa học 10 bài 14: Phản ứng hóa học và Enthalpy được chúng tôi biên soạn hướng dẫn bạn đọc trả lời các nội dung câu hỏi bài tập sách giáo khoa Hoá 10 Cánh diều.
Bài: Phản ứng hóa học và Enthalpy
Mở đầu trang 77 Hóa học 10: Cho các phản ứng sau:
(1) Phản ứng nung vôi: CaCO3 → CaO + CO2
(2) Phản ứng than cháy trong không khí: C + O2 → CO2
Trong hai phản ứng trên, phản ứng nào là tỏa nhiệt, phản ứng nào là thu nhiệt?
Phương pháp giải:
Phản ứng giải phóng năng lượng dưới dạng nhiệt (phản ứng tỏa nhiệt): phản ứng đốt cháy nhiên liệu, phản ứng tạo gỉ sắt, phản ứng oxi hóa glucose trong cơ thể, ...
Phản ứng hấp thụ năng lượng dưới dạng nhiệt (phản ứng thu nhiệt): phản ứng trong lò nung vôi, nung clinker xi măng, …
Lời giải:
(1) Phản ứng thu nhiệt.
(2) Phản ứng tỏa nhiệt.
I. Phản ứng tỏa nhiệt và phản ứng thu nhiệt
Phương pháp giải:
Phản ứng tỏa nhiệt: là phản ứng hóa học thường kèm theo sự giải phóng hoặc hấp thụ năng lượng dưới dạng nhiệt.
Phản ứng thu nhiệt: là phản ứng hóa học có sự cung cấp nhiệt cho phản ứng
Lời giải:
- Để nhận biết phản ứng tỏa nhiệt: Ta cảm nhận hoặc đo được nhiệt độ xung quanh phản ứng thí nghiệm đó tăng lên . Hoặc phản ứng không cần cung cấp nhiệt trong suốt quá trình xảy ra phản ứng
- Để nhận biết phản ứng thu nhiệt: Ta cần phải cung cấp nhiệt trong suốt quá trình xảy ra phản ứng thì phản ứng mới diễn ra
Vận dụng 1 trang 78 Hóa học 10: Dự đoán các phản ứng sau là tỏa nhiệt hay thu nhiệt?
a) Nung NH4Cl(s) tạo ra HCl(g) và NH3(g).
b) Cồn cháy trong không khí.
c) Phản ứng thủy phân collagen thành gelatin (là một loại protein dễ tiêu hóa) diễn ra khi hầm xương động vật.
Phương pháp giải:
Phản ứng giải phóng năng lượng dưới dạng nhiệt (phản ứng tỏa nhiệt): phản ứng đốt cháy nhiên liệu, phản ứng tạo gỉ sắt, phản ứng oxi hóa glucose trong cơ thể, ...
Phản ứng hấp thụ năng lượng dưới dạng nhiệt (phản ứng thu nhiệt): phản ứng trong lò nung vôi, nung clinker xi măng, …
Lời giải:
a) NH4Cl(s) → HCl(g) + NH3(g)
=> Phản ứng cần cung cấp nhiệt trong suốt quá trình phản ứng => Phản ứng thu nhiệt.
b) C2H5OH + O2 → CO2 + H2O
=> Phản ứng chỉ cần cung cấp nhiệt vào thời điểm ban đầu và có tỏa nhiệt trong quá trình phản ứng => Phản ứng tỏa nhiệt.
c) Collagen → gelatin
=> Phản ứng cần cung cấp nhiệt trong suốt quá trình phản ứng (hầm) =>Phản ứng tỏa nhiệt.
Phương pháp giải:
- Phản ứng tỏa nhiệt: phản ứng giải phóng năng lượng dưới dạng nhiệt
- Phản ứng thu nhiệt: phản ứng hấp thụ năng lượng dưới dạng nhiệt
Lời giải:
Phản ứng tỏa nhiệt: Sulfuric acid (H2SO4) + Đường, Xăng cháy trong không khí, Củi cháy trong không khí, Phản ứng tạo gỉ sắt, Nến cháy trong không khí …
Phản ứng thu nhiệt: Băng tan, Nước lỏng bay hơi, Luộc trứng, Nấu canh, Nung gốm…
II. Enthalpy tạo thành và biến thiên Enthalpy của phản ứng hóa học
Phương pháp giải:
Enthalpy tạo thành chuẩn (nhiệt tạo thành chuẩn) của một chất là lượng nhiệt kèm theo của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền nhất trong điều kiện chuẩn.
Lời giải:
Nhiệt tỏa ra khi hình thành 1 mol Na2O(s) ở điều kiện chuẩn từ phản ứng giữa Na(s) và O3(g) không được coi là nhiệt tạo thành chuẩn của Na2O(s) vì oxygen dạng phân tử O3 (ozone) không là dạng bền nhất.
Phương pháp giải:
ΔfH0298 giảm khi lượng chất tạo thành giảm.
Lời giải:
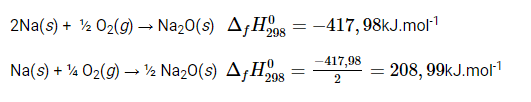
Câu hỏi 4 trang 79 Hóa học 10: Cho phản ứng:
N2(g) + 3H2(g) → 2NH3(g)
Ở điều kiện chuẩn, cứ 1 mol N2 phản ứng hết sẽ tỏa ra 92,22 kJ. Tính enthalpy tạo thành chuẩn của NH3.
Phương pháp giải:
Enthalpy tạo thành chuẩn (nhiệt tạo thành chuẩn) của một chất là lượng nhiệt kèm theo của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền nhất trong điều kiện chuẩn.
Lời giải:
N2(g) + 3H2(g) → 2NH3(g)
Cứ 1 mol N2 phản ứng hết tỏa ra 99,22kJ và tạo ra 2 mol NH3
=> 0,5 mol N2 phản ứng hết tỏa ra 49,61kJ và tạo ra 1 mol NH3
=> ΔfHo298 =−49,61kJ.mol−1 (enthalpy có giá trị âm vì đây là phản ứng tỏa nhiệt)
Câu hỏi 5 trang 79 Hóa học 10: Vì sao enthalpy tạo thành của một đơn chất bền lại bằng không?
Phương pháp giải:
Đơn chất bền: tồn tại sẵn trong điều kiện chuẩn, không cần phản ứng nào để tạo thành
Lời giải:
- Enthalpy tạo thành chuẩn của một chất là lượng nhiệt kèm theo của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền nhất trong điều kiện chuẩn
=> Đơn chất bền, không cần phản ứng nào từ đơn chất để tạo thành
=> Enthalpy tạo thành của một đơn chất bền bằng 0
Câu hỏi 6 trang 80 Hóa học 10: Giá trị ΔfHo298 của phản ứng sau là bao nhiêu kJ?
½ CH4(g) + O2(g) → ½ CO2(g) + H2O(l)
Phương pháp giải:
Dựa vào ví dụ (1) trang 80:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) ΔrH2980=−890,36kJ
ΔfHo298 tỉ lệ thuận với lượng chất tham gia và sản phẩm
Lời giải:
½ CH4(g) + O2(g) → ½ CO2(g) + H2O(l) ΔfHo298 =−890,362=−445,18kJ
Phương pháp giải:
ΔfHo298 tỉ lệ thuận với lượng chất tham gia và sản phẩm
Lời giải:
nC2H2 = 1/26 (mol)
Đốt cháy 1/26 mol C2H2 tỏa ra 49,98 kJ
=> Đốt cháy 1 mol C2H2 tỏa ra x kJ
=> x = 1 x 49,98 : (1/26) = 1299,48 kJ
=> ΔfHo298 = -1299,48 kJ (vì đây là phản ứng tỏa nhiệt nên enthalpy mang giá trị âm)
Phương pháp giải:
Khi đốt cháy 1 mol CH4 tỏa ra 890,36 kJ
Để tạo thành 1 mol CaO bằng cách nung CaCO3 cần 178,29kJ
Lời giải:
- Khi đốt cháy 1 mol CH4 tỏa ra 890,36 kJ
- Để tạo thành 1 mol CaO bằng cách nung CaCO3 cần 178,29kJ
=> Số mol CH4 cần dùng để đốt cháy là: 178,29 : 890,36 = 0,2 mol
=> Số gam CH4 cần dùng để đốt cháy là: 0,2 x 16 = 3,2 (gam)
Phương pháp giải:
Sự oxi hóa chất béo, chất đường, tinh bột...trong cơ thể con người giúp giải phóng năng lượng, cung cấp năng lượng cho các hoạt động
Lời giải:
- Sự hô hấp cung cấp oxygen cho các phản ứng oxi hóa chất béo, chất đường, tinh bột,... trong cơ thể con người đó là các phản ứng giải phóng năng lượng
- Năng lượng kèm theo các phản ứng dùng để cung cấp năng lượng cho các hoạt động
Bài tập (trang 81)
(a) Phản ứng tạo gỉ kim loại
(b) Phản ứng quang hợp
(c) Phản ứng nhiệt phân
(d) Phản ứng đốt cháy
Phương pháp giải:
Phản ứng cần cung cấp năng lượng trong quá trình phản ứng là phản ứng thu nhiệt
Lời giải:
(a): Không cần cung cấp nhiệt
(b): Không cần cung cấp nhiệt
(c): Cần cung cấp nhiệt để nhiệt phân
(d): Chi cần nhiệt lúc khơi mào phản ứng
=> Phản ứng (c) là phản ứng cần cung cấp năng lượng trong quá trình phản ứng
Đáp án C
Phương pháp giải:
- Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt
- Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt
Lời giải:
- Phản ứng khi xảy ra làm nóng môi trường xung quanh => Phản ứng giải phóng năng lượng dưới dạng nhiệt => Phản ứng tỏa nhiệt
- Phản ứng khi xảy ra làm lạnh môi trường xung quanh => Phản ứng hấp thụ năng lượng dưới dạng nhiệt => Phản ứng thu nhiệt
Bài 3 trang 81 Hóa học 10: Cho biết phản ứng sau có ΔtHo298 > 0 và diễn ra ở ngay nhiệt độ phòng.
2NH4NO3(s) + Ba(OH)2.8H2O(s) → 2NH3(aq) + Ba(NO3)2(aq) + 10H2O(l)
Khi trộn đều một lượng ammonium nitrate (NH4NO3) rắn với một lượng barium hydroxide ngậm nước (Ba(OH)2.8H2O) ở nhiệt độ phòng thì nhiệt độ của hỗn hợp sẽ tăng hay giảm? Giải thích.
Phương pháp giải:
Khi phản ứng thu nhiệt thì Δt,H298o > 0
Lời giải:
Ta có: Δt,H298o > 0 => Đây là phản ứng thu nhiệt
=> Phản ứng sẽ hấp thụ năng lượng dưới dạng nhiệt
=> Nhiệt độ của hỗn hợp giảm
H2(g) + Cl2(g) → 2HCl(g) (*)
Những phát biểu sau dưới đây là đúng?
A. Nhiệt tạo thành của HCl là -184,6 kJ.mol-1.
B. Biến thiên enthalpy phản ứng (*) là -184,6 kJ.
C. Nhiệt tạo thành của HCl là -92,3 kJ.mol-1.
D. Biến thiên enthalpy phản ứng (*) là -92,3 kJ.
Phương pháp giải:
- Enthalpy tạo thành chuẩn của một chất là lượng nhiệt kèm theo của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền nhất trong điều kiện chuẩn
- Phản ứng tỏa nhiệt thì enthalpy mang giá trị âm
Lời giải:
A. Sai vì đó là nhiệt tạo thành của 2 mol HCl
B. Đúng vì (*) là phản ứng tỏa nhiệt nên enthalpy mang giá trị âm
C. Đúng vì nhiệt tạo thành tỉ lệ với số mol chất tạo thành, đây là phản ứng tỏa nhiệt nên mang giá trị âm
D. Sai vì phản ứng (*) ứng với 2 mol
=> Đáp án B, C đúng
>>>> Bài tiếp theo: Giải Hóa học 10 Cánh diều bài 15
Như vậy, VnDoc.com đã gửi tới các bạn Giải Hóa 10 bài 14: Phản ứng hóa học và Enthalpy. Ngoài ra, các em học sinh có thể tham khảo môn: Vật Lý 10 Cánh Diều và Toán 10 Cánh Diều Tập 1, Toán 10 Cánh Diều Tập 2, Sinh 10 Cánh Diều đầy đủ khác.








