Để phân biệt AlCl3 và KCl
Để phân biệt AlCl3 và KCl được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Để phân biệt AlCl3 và KCl
Trắc nghiệm: Để phân biệt AlCl3 và KCl ta dùng chất thử nào?
- NANO3
- НСІ
- NaOH
- H2SO4
Trả lời:
Đáp án đúng: C. NaOH
Giải thích:
- Dùng dung dịch NaOH để phân biệt AlCl3 và KCl vì khi cho từ từ đến dư dung dịch NaOH vào AlCl3 có hiện tượng xuất hiện kết tủa dạng keo sau đó kết tủa tan, còn KCl thì không có hiện tượng gì.
- Phương trình hóa học:
AlCl3 + 3NaOH → 3NaCl + Al(OH)3↓
Al(OH)3 + NaOH → NaAlO2 + 2H2O
I. Tìm hiểu về AlCl3
1. Định nghĩa
- Nhôm clorua là hợp chất tạo bởi nguyên tố nhôm và clo. Hợp chất này có màu trắng, nhưng các mẫu chất thường bị nhiễm chất sắt(III) clorua, tạo cho nó thường được thấy với màu vàng.
- Công thức phân tử: AlCl3
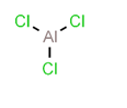
- Công thức cấu tạo:
2. Tính chất vật lí & nhận biết
- Tính chất vật lí: Là hợp chất có màu trắng, tan được trong nước, nhiệt độ nóng chảy và nhiệt độ sôi thấp.
Nhận biết: Cho dung dịch nhôm clorua tác dụng với dung dịch AgNO3, thấy xuất hiện kết tủa trắng:
AlCl3 + AgNO3 → AgCl↓ + NaNO3
3. Tính chất hóa học
- Mang đầy đủ tính chất hóa học của muối
+ Tác dụng với dung dịch bazo:
AlCl3 + NaOH(vừa đủ) → NaCl + Al(OH)3
+ Tác dụng với dung dịch muối khác:
AlCl3 + AgNO3 → AgCl↓ + NaNO3
+ Phản ứng với kim loại mạnh hơn:
3Mg + 2AlCl3 → 3MgCl2 + 2Al
4. Điều chế
- Cho nhôm phản ứng với axit HCl:
2Al + 6HCl → 2AlCl3 + 3H2
- Cho nhôm tác dụng với clo
2Al + 3Cl2 → 2AlCl3
5. Ứng dụng
- Nhôm clorua chủ yếu được sản xuất và tiêu thụ trong lĩnh vực sản xuất kim loại nhôm, nhưng một lượng lớn cũng được sử dụng trong các lĩnh vực khác của ngành công nghiệp hóa học.
II. Tìm hiểu về KCl
1 . Tính chất vật lý
- Kali clorua là một muối của kali với ion clorua. Nó không mùi và có tinh thể thủy tinh màu trắng hoặc không màu. Ở dạng chất rắn kali clorua tan trong nước và dung dịch của nó có vị giống muối ăn.
- Khối lượng riêng: 1.984 g/cm3
- Khối lượng mol: 74.5513 g·mol-1
- Điểm nóng chảy: 770°C (1.040 K; 1.420°F)
- Điểm sôi: 1.420°C (1.690 K; 2.590°F)
- Độ hòa tan trong nước: 21.74% (0°C)
- Độ axit (pKa): ~7
- Nó được sản xuất trong công nghiệp bằng cách kết tinh phân đoạn của khoáng sylvite và carnallite hoặc từ dung dịch nước hồ.
2. Tính chất hóa học
- KCl là 1 muối trung hòa nên nó sẽ có tính chất của muối.
- Phân ly hoàn toàn trong nước tạo thành các ion âm và ion dương:
+ KCl → K+ + Cl-
- Tác dụng với dung dịch chứa AgNO3:
KCl + AgNO3 → AgCl ↓ + KNO3
=> Phương trình ion rút gọn: Ag+ + Cl- → AgCl↓
- Kali Clorua là muối được tạo từ bazơ mạnh và axit mạnh nên nó mang tính trung tính; do đó tương đối trơ về mặt hóa học.
- Tác dụng với H2SO4 đặc
2KCl + H2SO4 đặc → K2SO4 + 2HCl
3. Điều chế
- Chủ yếu được khai thác từ các mỏ muối bằng cách kết tinh từ dung dịch; tuyển nổi hoặc tách tĩnh điện từ các khoáng chất phù hợp.
- Ngoài ra còn được sản xuất từ nước nhưng sản lượng khá ít.
4. Ứng dụng
- Kali clorua được dùng làm nguyên liệu cung cấp K trong sản xuất phân bón. Nó dễ tan trong nước bón vào đất cây có thể sử dụng ngay. Sau khi bón vào đất cây có thể thay thế ion H" trong phức hệ hấp thụ làm cho dung dịch đất hóa chua.
- Khi sử dụng dạng phân đơn, KCl thường được rắc đều trên lớp đất bề mặt (bên trên lớp đất trồng và đất canh tác). Nó cũng có thể được bón tập trung gần hạt. KCl xung quanh hạt giống sẽ bảo vệ cho hạt giống tránh khỏi những ảnh hưởng xấu đến quá trình nảy mầm khi các loại phân bón phân giải sẽ làm tăng sự tập trung của các muối hòa tan.
- KCl phân giải nhanh trong vào nước trong đất. Ion K+ được giữ lại từ quá trình chuyển hóa ion của đất sét và chất hữu cơ. Phần Cl- sẽ hòa đi cùng với nước. Loại KCl độ tinh khiết cao có thể hòa tan làm phân dạng lỏng hoặc bổ sung vào hệ thống nước tưới tiêu.
- Nhược điểm của KCI là phân có để lại ion Cl làm ảnh hưởng đến cây, đặc biệt phẩm chất nông sản nên tránh bón cho các loại rau quả.
- Kali là yếu tố dinh dưỡng cần thiết cho con người và động vật nhưng là loại cơ thể không dự trữ được. KCl có thể được dùng như loại muối thay thế trong chế độ ăn hạn chế muối natri.
- Nó cũng được sử dụng trong chất làm mềm nước thay thế cho canxi trong nước.
- Kali clorua được ứng dụng trong y học để bào chế thuốc và thuốc tiêm nhằm điều trị bệnh thiếu kali máu. KCl là loại chất rất cần thiết cho cơ thể, trong các chức năng hoạt động của hệ tiêu hóa, tim, thậm, cơ và cả hệ thần kinh. Vì thế lượng kali trong máu thấp là cực kỳ nguy hiểm.
- Mẫu tiêm tĩnh mạch nằm trong Danh sách các loại thuốc thiết yếu của Tổ chức Y tế Thế giới , loại thuốc quan trọng nhất cần có trong hệ thống y tế cơ bản.
- Ngoài ra nó còn giúp tạo môi trường sống sạch, khỏe mạnh hơn cho các động vật thủy sinh như tôm, cá, cua, lươn. Điều này giúp KCl được ứng dụng trong lĩnh vực nuôi trồng thủy hải sản.
----------------------------------------
Trên đây VnDoc đã giới thiệu tới các bạn nội dung bài Để phân biệt AlCl3 và KCl. Để có kết quả học tập tốt và hiệu quả hơn, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Hóa học 10, Chuyên đề Vật Lý 10, Chuyên đề Hóa học 10, Giải bài tập Toán 10. Tài liệu học tập lớp 10 mà VnDoc tổng hợp biên soạn và đăng tải.