Giải Hóa học 10 Chân trời sáng tạo bài 16
Giải Hóa học 10 bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học được VnDoc biên soạn hướng dẫn bạn đọc trả lời các nội dung câu hỏi bài tập sách giáo khoa Hoá 10 Chân trời sáng tạo.
Bài: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học

Những yếu tố nào ảnh hưởng đến tốc độ của các quá trình biến đổi trên?
Lời giải:
(a) Ảnh hưởng của nhiệt độ
(b) Ảnh hưởng của áp suất
(c) Ảnh hưởng của nồng độ
1. Ảnh hưởng của nồng độ
Phương pháp giải:
Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng
Lời giải:
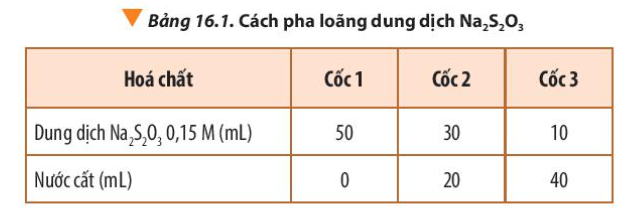
Thể tích dung dịch Na2S2O3 càng nhiều => Nồng độ Na2S2O3 càng cao => Thời gian xuất hiện kết tủa càng nhanh
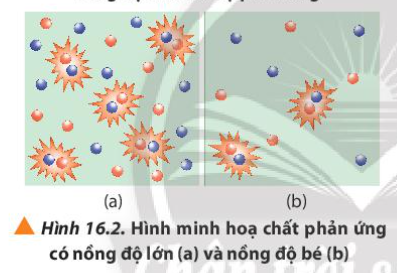
Phương pháp giải:
Nồng độ cao => Mật độ các hạt chất tham gia cao => Tăng độ va chạm giữa các hạt chất tham gia
Lời giải:
Khi nồng độ Na2S2O3 cao => Các hạt phân tử Na2S2O3 nhiều
=> Tăng sự va chạm giữa Na2S2O3 và phân tử H2SO4
=> Tăng khả năng tạo thành kết tủa
Phương pháp giải:
Nồng độ H2SO4 giảm => Tốc độ phản ứng giảm
Lời giải:
Khi pha loãng dung dịch H2SO4
=> Nồng độ H2SO4 giảm
=> Tốc độ phản ứng giảm
2. Ảnh hưởng của nhiệt độ

Lời giải:
Khi tăng nhiệt độ, tốc độ phản ứng tăng
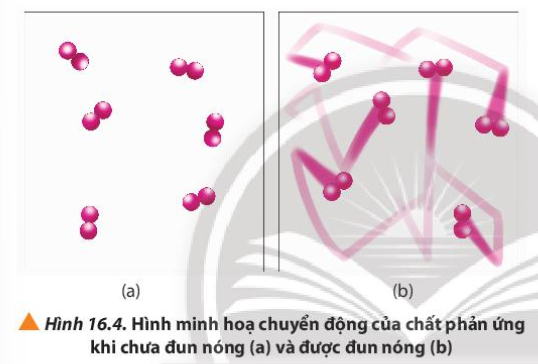
Phương pháp giải:
Khi tăng nhiệt độ, các chất chuyển động với tốc độ lớn
Lời giải:
- Cốc (2) ở nhiệt độ thường, các hạt KMnO4, H2C2O4 và H2SO4 chuyển động với tốc độ nhỏ, khả năng va chạm ít => Phản ứng diễn ra chậm => Lâu mất màu
- Cốc (1) ở nhiệt độ cao, các hạt KMnO4, H2C2O4 và H2SO4 chuyển động với tốc độ lớn, khả năng va chạm cao => Phản ứng diễn ra nhanh => Nhanh mất màu
Phương pháp giải:

Lời giải:

3. Ảnh hưởng của áp suất
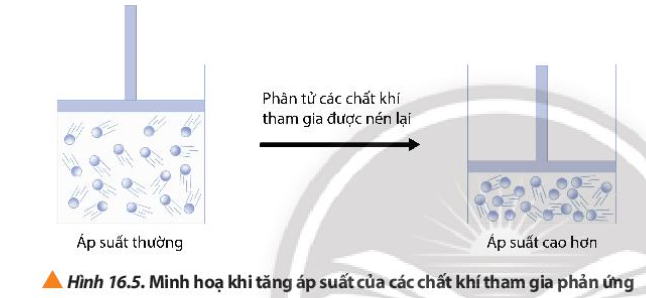
Phương pháp giải:
Quan sát Hình 16.5 và rút ra nhận xét
Lời giải:
Khi tăng áp suất của bình, mật độ phân bố của các phân tử chất khí trong bình kín tăng
Luyện tập trang 101 Hóa học 10: Xét các phản ứng xảy ra trong bình kín:
2CO(g) + O2(g) → 2CO2(g) (1)
NH4Cl(s) → NH3(g) + HCl(g) (2)
Yếu tố áp suất ảnh hưởng đến tốc độ của phản ứng nào? Khi tăng áp suất, tốc độ phản ứng thay đổi như thế nào?
Lời giải:
- Trong phản ứng hóa học có sự tham gia của chất khí, áp suất sẽ ảnh hưởng đến tốc độ phản ứng
=> Yếu tố áp suất ảnh hưởng đến tốc độ phản ứng (1)
- Khi tăng áp suất, tốc độ phản ứng tăng
4. Ảnh hưởng của bề mặt tiếp xúc
Phương pháp giải:
Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng
Lời giải:
Tốc độ khí thoát ra ở bình 2 nhanh hơn bình 1
Câu hỏi 7 trang 101 Hóa học 10 : Nhận xét mối liên hệ giữa tốc độ phản ứng với kích thước của CaCO3
Lời giải:
Kích thước các hạt CaCO3 càng nhỏ thì tốc độ phản ứng càng nhanh
Câu hỏi 8 trang 102 Hóa học 10: Quan sát Hình 16.7, giải thích kết quả của thí nghiệm 2
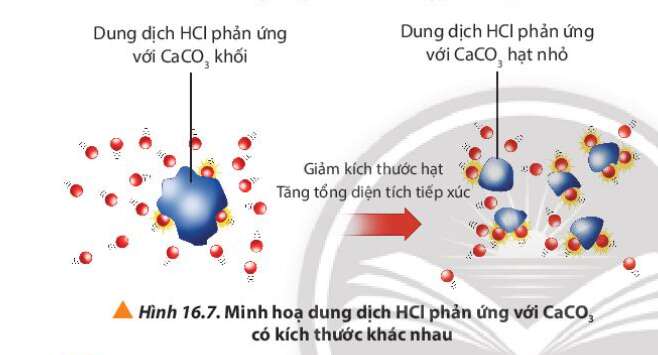
Phương pháp giải:
Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng
Lời giải:
- Ở bình 2, CaCO3 ở dạng hạt nhỏ
=> Tổng diện tích tiếp xúc giữa CaCO3 với HCl tăng
=> Tốc độ phản ứng bình 2 tăng
=> Tốc độ khí thoát ra ở bình 2 nhanh hơn
Phương pháp giải:
Khi củi được chẻ nhỏ, tổng diện tích tiếp xúc của củi với oxygen tăng
Lời giải:
- Khi củi được chẻ nhỏ => Tổng diện tích tiếp xúc của củi với oxygen tăng
- Mà oxygen duy trì sự cháy
=> Tăng tốc độ cháy của củi
=> Củi sẽ cháy nhanh hơn và mạnh hơn
5. Ảnh hưởng của chất xúc tác
Lời giải:
- Hiện tượng: Tàn đóm ở ống nghiệm (1) cháy le lói, tàn đóm ở ống nghiệm (2) bùng cháy
=> Tàn đóm ở ống n
Luyện tập trang 103 Hóa học 10: Tại sao khi nhai kĩ cơm, cảm nhận cơm có vị ngọt hơn
Phương pháp giải:
Chất xúc tác làm tăng tốc độ của phản ứng hóa học
Lời giải:
Khi ta nhai cơm lâu trong miệng thấy có cảm giác ngọt vì tinh bột trong cơm đã chịu tác dụng của enzim amilaza trong nước bọt và biến đổi một thành phần thành đường mantôzơ, đường này đã tác động vào các gai vị giác trên lưỡi cho ta cảm giác ngọt.
6. Ý nghĩa thực tiễn của tốc độ phản ứng trong đời sống và sản xuất

Phương pháp giải:
a) Ảnh hưởng của nồng độ
b) Ảnh hưởng của áp suất
c) Ảnh hưởng của diện tích tiếp xúc
d) Ảnh hưởng của nhiệt độ
Lời giải:
a) Ảnh hưởng của nồng độ: Dùng bình chứa oxygen có nồng độ oxygen cao hơn không khí => Phản ứng cháy dễ dàng xảy ra
b) Ảnh hưởng của áp suất: Dùng nồi áp suất làm tăng áp suất trong nồi => Thực phẩm trong nồi áp suất sẽ nhanh chín hơn
c) Ảnh hưởng của diện tích tiếp xúc: Đậy nắp lò làm hạn chế diện tích tiếp xúc của than với oxygen trong không khí => Phản ứng cháy diễn ra chậm => Giữ than cháy được lâu hơn
d) Ảnh hưởng của nhiệt độ: Khi để thức ăn trong tủ lạnh => Nhiệt độ bị giảm => Kìm hãm phản ứng oxi hóa thức ăn => Thức ăn sẽ lâu bị ôi thiu
Lời giải:
Trong quá trình lên men giấm, người ta thường cho chuối hay nước dừa vào giúp tăng mùi thơm của giấm và kích thích con giấm lên men nhanh hơn vì con giấm sử dụng đường làm thức ăn.

Phương pháp giải:
Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng
Lời giải:
Khi chia con gà thành các phần nhỏ thì món ăn sẽ nhanh chín hơn. Vì khi chia nhỏ, tổng diện tích tiếp xúc của con gà với chảo nóng nhiều hơn => Tốc độ chín thức ăn nhanh hơn
Lời giải:
- Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng
- Khi tăng nhiệt độ, tốc độ phản ứng tăng
- Đối với phản ứng có chất khí tham gia, tốc độ phản ứng tăng khi tăng áp suất
- Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng
- Chất xúc tác làm tăng tốc độ của phản ứng hóa học, nhưng vẫn được bảo toàn về chất lượng khi kết thúc phản ứng
Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)
Tốc độ khí H2 thoát ra như thế nào khi thay đổi các yếu tố dưới đây
a) Thay a g Zn hạt bằng a g bột Zn
b) Thay dung dịch HCl 2M bằng dung dịch HCl 1M
c) Thực hiện phản ứng ở nhiệt độ cao hơn bằng cách đun nóng nhẹ dung dịch HCl
Phương pháp giải:
a) Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng
b) Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng
c) Khi tăng nhiệt độ, tốc độ phản ứng tăng
Lời giải:
a) Khi thay a g hạt Zn = a g bột Zn
=> Chất tham gia được nghiền nhỏ
=> Diện tích bề mặt tiếp xúc của Zn với HCl tăng
=> Tốc độ phản ứng tăng
=> Khí thoát ra nhanh hơn
b) Khi thay dung dịch HCl 2 M = dung dịch HCl 1 M
=> Nồng độ chất tham gia giảm
=> Tốc độ phản ứng giảm
=> Khí thoát ra chậm hơn
c) Khi đun nóng nhẹ dung dịch HCl
=> Nhiệt độ của phản ứng tăng
=> Tốc độ phản ứng tăng
=> Khí thoát ra nhanh hơn
Bài 4 trang 104 Hóa học 10: Cho phương trình hóa học của phản ứng: 2CO(g) + O2(g) → 2CO2(g)
Nếu hệ số nhiệt độ Van’t Hoff bằng 2, tốc độ phản ứng thay đổi như thế nào khi tăng nhiệt độ của phản ứng từ 30oC lên 60oC?
Phương pháp giải:

Lời giải:

>>> Bài tiếp theo: Giải Hóa học 10 Chân trời sáng tạo bài 17
Như vậy, VnDoc đã gửi tới các bạn Giải Hóa học 10 bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học. Ngoài ra, các em học sinh có thể tham khảo môn Ngữ văn 10 Kết nối tri thức tập 1, Vật Lý 10 Kết nối tri thức và Toán 10 Kết nối tri thức tập 1, Toán 10 Kết nối tri thức tập 2, Sinh 10 Kết nối tri thức đầy đủ khác.









