Giải Hóa học 10 Kết nối tri thức bài 14
Giải Hóa học 10 bài 14: Ôn tập chương 3 sách Kết nối tri thức được biên soạn hướng dẫn bạn đọc trả lời các nội câu hỏi bài tập SGK Hóa 10 Kết nối tri thức. Hy vọng thông qua nội dung tài liệu, sẽ giúp bạn đọc hoàn thành tốt các nội dung câu hỏi.
Bài: Ôn tập chương 3
I. Hệ thống hóa kiến thức
Hoàn thành sơ đồ hệ thống hóa kiến thức trang 68 Hóa học 10:
Lời giải:
Liên kết hóa học gồm:
- Liên kết cộng hóa trị
+ Khái niệm: là liên kết hóa học được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron chung.
+ Kiểu liên kết:Liên kết đơn (-); liên kết đôi (=) và liên kết ba (≡).
Không phân cực: cặp electron dùng chung nằm chính giữa hai nguyên tử.
Ví dụ: Cl2, Br2, …
- Có phân cực: cặp electron dùng chung lệch về nguyên tử có độ âm điện lớn hơn.
Ví dụ: H2O, CO, NH3, …
Cho nhận: cặp electron dùng chung là do một nguyên tử đóng góp.
Ví dụ: SO2, HNO3, …
- Liên kết ion
+ Khái niệm: là liên kết hóa học được hình thành giữa hai ion mang điện tích trái dấu (tồn tại trong khối tinh thể)
Ví dụ: NaCl, NaF, CaCl2, …
+ Tinh thể ion: Các ion âm và dương sắp xếp tại các nút của mạng tinh thể theo trật tự luân phiên, liên kết bằng lực hút tĩnh điện của chúng.

- Liên kết hydrogen và tương tác van der waals
+ Khái niệm: đều là liên kết giữa các phân tử (hay nguyên tử) trung hòa hút nhau bởi bản chất tĩnh điện giữa các lưỡng cực δ+ và δ-.
+ Liên kết hydrogen: 𝐻𝛿+−𝑂𝛿−−𝐻𝛿+...𝐹𝛿−−𝐻𝛿+...
+ Tương tác Van der waals:

+ Ảnh hưởng: đều làm tăng nhiệt độ sôi, nhiệt độ nóng chảy của các chất.
II. Luyện tập
Câu hỏi 1 trang 69 Hóa học 10 : Dãy các chất nào dưới đây mà tất cả các phân tử đều có liên kết ion?
Lời giải:
Đáp án đúng là: B
Em cần nhớ:
- Liên kết ion thường được hình thành giữa kim loại điển hình và phi kim điển hình.
- Hiệu độ âm điện |Δx| ≥ 1,7
A. Loại vì tất cả đều là liên kết cộng hóa trị
C. Loại vì HCl, H2S, N2O là liên kết cộng hóa trị.
D. Loại vì H2SO4, H3PO4, HCl là liên kết cộng hóa trị.
Lời giải:
Đáp án đúng là: D
Phân tử được tạo thành từ hai nguyên tử giống nhau đều là liên kết cộng hóa trị không phân cực do có hiệu độ âm điện bằng 0.
Lời giải:
|
|
Công thức cấu tạo |
Công thức Lewis |
|
PH3 |
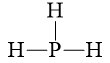 |
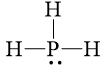 |
|
H2O |
H – O – H |
|
|
C2H6 |
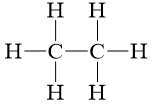 |
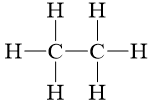 |
- Các nguyên tử O, P, N đều tạo liên kết phân cực với H, trong đó nguyên tử O có độ âm điện lớn hơn cả nên liên kết O – H sẽ phân cực nhất.
⇒ Phân tử H2O có liên kết phân cực mạnh nhất.
Lời giải:
Trong phân tử CH4, hiệu độ âm điện của C và H: 2,55 – 2,2 = 0,35
⇒ Liên kết giữa C và H là liên kết cộng hóa trị không phân cực.
Trong phân tử CaCl2, hiệu độ âm điện của Ca và Cl: 3,16 – 1 = 2,16
⇒ Liên kết giữa Ca và Cl là liên kết ion.
Trong phân tử HBr, hiệu độ âm điện của H và Br: 2,96 – 2,2 = 0,76
⇒ Liên kết giữa H và Br là liên kết cộng hóa trị phân cực.
Trong phân tử NH3, hiệu độ âm điện của N và H: 3,04 – 2,2 = 0,84
⇒ Liên kết giữa N và H là liên kết cộng hóa trị phân cực.
Câu hỏi 5 trang 69 Hóa học 10: Cho dãy các oxide sau Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7.
a) Độ phân cực của các liên kết trong dãy các oxide trên thay đổi thế nào?
Lời giải:
a)Độ phân cực của các liên kết trong dãy các oxide giảm dần: Na2O > MgO > Al2O3 > SiO2 > P2O5 > SO3 > Cl2O7. Do hiệu độ âm điện giảm dần.
b)
|
Oxide |
Hiệu độ âm điện |
Loại liên kết |
|
Na2O |
2,51 |
liên kết ion |
|
MgO |
2,13 |
liên kết ion |
|
SiO2 |
1,54 |
liên kết cộng hóa trị có cực |
|
P2O5 |
1,25 |
liên kết cộng hóa trị có cực |
|
SO3 |
0,86 |
liên kết cộng hóa trị có cực |
|
Cl2O7 |
0,28 |
liên kết cộng hóa trị không cực |
Câu hỏi 6 trang 69 Hóa học 10:
a) Cho dãy các phân tử C2H6, CH3OH, NH3. Phân tử nào trong dãy có thể tạo liên kết hydrogen? Vì sao?
b) Vẽ sơ đồ biểu diễn liên kết hydrogen giữa các phân tử đó.
Lời giải:
Em cần nhớ: Điều kiện cần và đủ để tạo thành liên kết hydrogen là:
- Nguyên tử hydrogen liên kết với các nguyên tử có độ âm điện lớn như F, O, N,…
- Nguyên tử F, O, N,… liên kết với hydrogen phải có ít nhất một cặp electron hóa trị chưa liên kết.
a)
- Phân tử CH3OH và NH3 có thể tạo liên kết hydrogen vì có nguyên tử H liên kết với nguyên tử có độ âm điện cao là O, N.
Bên cạnh đó nguyên tử N, O đều có cặp electron chưa tham gia liên kết và có liên kết với nguyên tử hydrogen.
- Phân tử C2H6 không thể tạo liên kết hydrogen vì mặc dù có H liên kết với nguyên tử C có độ âm điện cao nhưng nguyên tử C không có cặp electron hóa trị chưa liên kết.
b) Sơ đồ biểu diễn liên kết hydrogen giữa các phân tử NH3 và CH3OH là:
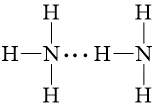
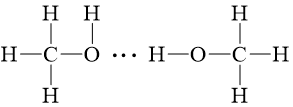
>>> Bài tiếp theo: Giải Hóa học 10 Kết nối tri thức bài 15
Như vậy, VnDoc.com đã gửi tới các bạn Giải Hóa học 10 bài 14: Ôn tập chương 3. Ngoài ra, các em học sinh có thể tham khảo môn Ngữ văn 10 Kết nối tri thức tập 1, Vật Lý 10 Kết nối tri thức và Toán 10 Kết nối tri thức tập 1, Toán 10 Kết nối tri thức tập 2, Sinh 10 Kết nối tri thức đầy đủ khác.









