Muối hỗn tạp là gì?
VnDoc xin giới thiệu bài Muối hỗn tạp là gì? được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Muối hỗn tạp là gì?
Câu hỏi: Muối hỗn tạp là gì? Tại sao nói clorua vôi là muối hỗn tạp?
Trả lời:
- Muối của một kim loại với nhiều loại gốc axit khác nhau được gọi là muối hỗn tạp.
- Clorua vôi là muối hỗn tạp vì:
Công thức phân tử của clorua vôi là CaOCl2 và có công thức cấu tạo là
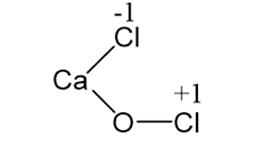
Đây là muối của kim loại canxi với hai loại gốc axit là clorua Cl- và hipoclorit ClO–.
1. Muối là gì?
- Muối là hợp chất mà phân tử gồm hay nhiều nguyên tử kim loại liên kết với một hay nhiều gốc axit.
Trong hóa học, muối là một hợp chất hóa học bao gồm một tổ hợp ion của các cation và anion. Muối bao gồm số lượng liên quan của các cation (ion mang điện tích dương) và anion (ion mang điện tích âm) để sản phẩm là trung hòa về điện (không có điện tích thực). Các ion thành phần này có thể là vô cơ, chẳng hạn như chloride (Cl -), hoặc hữu cơ, chẳng hạn như axetat (CH3CO2−); và có thể là dạng đơn nguyên tử, chẳng hạn như fluoride (F -) hoặc đa nguyên tử, chẳng hạn như sunfat (SO42−).
Khi các muối hòa tan trong nước, chúng được gọi là chất điện phân, và có khả năng dẫn điện, một đặc điểm giống với các muối nóng chảy. Hỗn hợp của nhiều ion khác nhau ở dạng hòa tan trong tế bào chất của tế bào, trong máu, nước tiểu, nhựa cây và nước khoáng — thường không tạo nên muối sau khi nước bốc hơi hết. Tuy nhiên, hàm lượng muối trong chúng được tính theo lượng ion có mặt trong đó.
- Công thức hóa học của muối gồm hai phần: kim loại và gốc axit
Ví dụ: Muối có công thức hóa học Na2SO3 gồm phần kim loại là Na, phần gốc axit là gốc sunfit (=SO3).
- Theo thành phần, muối được chia làm hai loại:
+ Muối trung hòa: Là muối mà trong gốc axit không có nguyên tử hiđro có thể thay thế bằng nguyên tử kim loại.
Ví dụ: Na2SO4, Na2CO3, CaCO3
+ Muối axit: Là muối mà trong đó gốc axit của phân tử còn nguyên tử hiđro H chưa được thay thế bằng kim loại.
Ví dụ: NaHSO4, K2HPO4, Ba(HCO3)2,...
Hoá trị của gốc axit bằng số nguyên tử hiđro đã được thay thế bằng kim loại.
2. Cách đọc tên Muối
Tên muối = tên kim loại (kèm hóa trị nếu có nhiều hóa trị) + tên gốc axit
VD: Na2SO4: natri sunfat
CaCO3: canxi cacbonat
FeSO4: sắt (II) sunfat
CaHPO4: canxi hydrophotphat
Các gốc axit thường dùng:
|
|
Gốc axit |
Tên gọi |
|
Phân tử axit có 1H -> có 1 gốc axit HCl, HNO3, HBr,... |
- Cl - NO3 |
Clorua nitrat |
|
Phân tử axit có 2H -> có 2 gốc axit H2SO4, H2S, H2CO3 H2SO3 |
- HSO4 = SO4 - HS = S - HCO3 = CO3 - HSO3 |
Hidrosunfat Sunfat Hidrosunfua Sunfua Hidro cacbonat Cacbonat: hidrosunfit |
|
Phân tử axit có 3H -> có 3 gốc axit |
- H2PO4 = HPO4 ≡ PO4 (III) |
Đihidrophotphat Hidrophotphat Photphat |
3. Tính chất hóa học của muối
a, Muối có thể làm đổi màu chất chỉ thị màu
- Quỳ tím chuyển sang màu đỏ khi:
+ Muối có tính axit;
+ Khi kim loại yếu kết hợp với gốc axit mạnh.
- Quỳ tím chuyển sang màu xanh khi:
+ Muối có tính bazo mạnh hơn;
+ Khi kim loại mạnh kết hợp với gốc axit yếu.
- Quỳ tím không chuyển màu khi:
+Muối trung tính;
+Khi kim loại mạnh kết hợp với gốc axit mạnh hoặc tính chất của cả 2 ngang bằng nhau.
b, Khi muối tác dụng với kim loại
Muối tác dụng với kim loại sẽ tạo nên muối mới và kim loại mới.
Ví dụ minh họa:
Fe + CuSO4 → FeSO4 + Cu↓
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
c, Khi muối tác dụng với axit
Muối khi tác dụng với axit sẽ tạo thành axit mới và muối mới. Tuy nhiên, nếu thành phẩm của phản ứng khi tạo ra là axit yếu thì không thể tồn tại được mà sẽ tự chuyển hóa thành chất khác bền hơn.
Ví dụ minh họa:
AgNO3 + HCl → AgCl ↓ + HNO3
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
d, Khi muối tác dụng với muối
Khi 2 muối tác dụng với nhau sẽ tạo nên 2 loại muối mới.
Ví dụ minh họa: AgNO3 + NaCl → NaNO3 + AgCl↓. Phản ứng này làm xuất hiện kết tủa trắng do AgCl sinh ra.
e, Khi muối tác dụng với bazơ
Muối mới và bazo mới sẽ được tạo ra khi muối phản ứng với bazơ.
Ví dụ minh họa: Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3↓
Phản ứng hủy muối
KClO3, KMnO4, CaCO3, là những loại muối dễ bị phân hủy ở nhiệt độ cao.
Ví dụ minh họa:
2KClO3 t0→ 2KCl + 3O2
CaCO3 → CaO + CO2
----------------------------------------
Trên đây VnDoc đã giới thiệu tới các bạn nội dung bài Muối hỗn tạp là gì? Để có kết quả học tập tốt và hiệu quả hơn, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Hóa học 10, Chuyên đề Vật Lý 10, Chuyên đề Hóa học 10, Giải bài tập Toán 10. Tài liệu học tập lớp 10 mà VnDoc tổng hợp biên soạn và đăng tải.










