Giải Hóa 10 Bài 4: Ôn tập chương 1 KNTT
Giải Hóa 10 kết nối tri thức bài 4: Ôn tập chương 1
- Câu 1 trang 27 SGK Hóa 10 KNTT
- Câu 2 trang 27 SGK Hóa 10 KNTT
- Câu 3 trang 27 SGK Hóa 10 KNTT
- Câu 4 trang 27 SGK Hóa 10 KNTT
- Câu 5 trang 27 SGK Hóa 10 KNTT
- Câu 6 trang 27 SGK Hóa 10 KNTT
- Câu 7 trang 27 SGK Hóa 10 KNTT
- Câu 8 trang 27 SGK Hóa 10 KNTT
- Câu 9 trang 27 SGK Hóa 10 KNTT
- Câu 10 trang 27 SGK Hóa 10 KNTT
Giải Hóa 10 Bài 4: Ôn tập chương 1 KNTT được VnDoc biên soạn hướng dẫn bạn đọc trả lời các nội dung câu hỏi sách giáo khoa Hóa 10 kết nối tri thức bài 4 Ôn tập chương 1.
>> Bài trước đó: Giải Hóa 10 Bài 3: Cấu trúc lớp vỏ electron nguyên tử KNTT
Câu 1 trang 27 SGK Hóa 10 KNTT
Số proton, neutron và electron của ![]() \(_{19}^{39}K\) lần lượt là
\(_{19}^{39}K\) lần lượt là
| A. 19, 20, 39 | B. 20, 19, 39 | C. 19, 20, 19 | D. 19, 19, 20 |
Hướng dẫn giải bài tập
Nguyên tử ![]() \(_{19}^{39}K\)cho biết:
\(_{19}^{39}K\)cho biết:
Số hiệu nguyên tử = số proton = số electron = 19
Số khối = 39 => Số neutron = 39 – 19 = 20
=> Số proton, neutron và electron của ![]() \(_{19}^{39}K\) lần lượt là 19, 20, 19
\(_{19}^{39}K\) lần lượt là 19, 20, 19
Câu 2 trang 27 SGK Hóa 10 KNTT
Nguyên tử của nguyên tố nào sau đây có 3 electron thuộc lớp ngoài cùng
![]() \(A. \; _{11}^{23}Na\)
\(A. \; _{11}^{23}Na\)
![]() \(B. \; _{7}^{14}N\)
\(B. \; _{7}^{14}N\)
![]() \(C. \; _{13}^{27}Al\)
\(C. \; _{13}^{27}Al\)
![]() \(D. \; _{6}^{12}C\)
\(D. \; _{6}^{12}C\)
Hướng dẫn giải bài tập
Đáp án C
![]() \(\; _{11}^{23}Na\) có Z = 11
\(\; _{11}^{23}Na\) có Z = 11
Cấu hình electron: 1s22s22p63s1
=> Có 1 electron ở lớp ngoài cùng
![]() \(\; _{7}^{14}N\) có Z = 7
\(\; _{7}^{14}N\) có Z = 7
Cấu hình electron: 1s22s22p3
=> Có 5 electron ở lớp ngoài cùng
![]() \(\; _{13}^{27}Al\) có Z = 13
\(\; _{13}^{27}Al\) có Z = 13
Cấu hình electron: 1s22s22p63s23p1
=> Có 3 electron ở lớp ngoài cùng
![]() \(\; _{6}^{12}C\) có Z = 6
\(\; _{6}^{12}C\) có Z = 6
Cấu hình electron: 1s22s22p2
=> Có 4 electron ở lớp ngoài cùng
Câu 3 trang 27 SGK Hóa 10 KNTT
Nguyên tử của nguyên tố potassium có 19 electron. Ở trạng thái cơ bản, potassium có số orbital chứa electron là
| A. 8 | B. 9 | C. 11 | D. 10 |
Hướng dẫn giải bài tập
Nguyên tử potassium có 19 electron
=> Cấu hình electron: 1s22s22p63s23p64s1
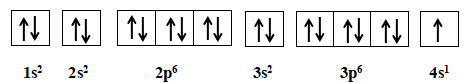
Potassium có 10 orbital chứa electron.
Đáp án D
>> Tham khảo thêm đáp án: Nguyên tử của nguyên tố potassium có 19 electron ...
Câu 4 trang 27 SGK Hóa 10 KNTT
Nguyên tử của nguyên tố sodium (natri) (Z = 11) có cấu hình electron là
| A. 1s22s22p63s2 | B. 1s22s22p6 | C. 1s22s22p63s1 | D. 1s22s22p53s2 |
Hướng dẫn giải bài tập
Cấu hình electron: 1s22s22p63s1
Đáp án C
Câu 5 trang 27 SGK Hóa 10 KNTT
Tổng số hạt proton, neutron và electron trong nguyên tử X là 58. Số hạt mang điện nhiều hơn số hạt không mang điện là 18. X là
| A. Cl | B. Ca | C. K | D. S |
Hướng dẫn giải bài tập
Gọi số hạt proton, electron và neutron trong nguyên tử X lần lượt là p, e, n
Ta có:
Nguyên tử X có tổng số hạt proton, neutron và electron là 58:
=> p + e + n = 58 <=> 2p +n = 58 (vì p = e) (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 18:
=> p + e – n = 18 <=> 2p - n = 18 (2)
Giải phương trình (1), (2)
p = e = 19 và n = 20
=> X là Kali
Đáp án C
>> Tham khảo thêm đáp án: Tổng số hạt proton, neutron và electron trong nguyên tử X ...
Câu 6 trang 27 SGK Hóa 10 KNTT
Nguyên tố chlorine có Z = 17. Hãy cho biết số lớp electron, số electron thuộc lớp ngoài cùng, số electron độc thân của nguyên tử chlorine
Hướng dẫn giải bài tập
Nguyên tố chlorine có Z = 17
Cấu hình electron: 1s22s22p63s23p5
Cấu hình chlorine theo ô orbital
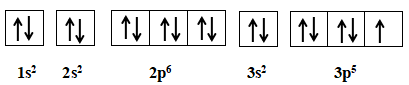
+ Số lớp electron của Chlorine: 3
+ Số electron của Chlorine thuộc lớp ngoài cùng: 7
+ Số electron của Chlorine độc thân: 1
>> Tham khảo thêm đáp án: Nguyên tố chlorine có Z = 17 ...
Câu 7 trang 27 SGK Hóa 10 KNTT
Nguyên tử khối trung bình của vanadium (V) là 50.9975. Nguyên tố V có 2 đồng vị trong đó đồng vị ![]() \(_{23}^{50}V\) chiếm 0.25%. Tính số khối của đồng vị còn lại
\(_{23}^{50}V\) chiếm 0.25%. Tính số khối của đồng vị còn lại
Hướng dẫn giải bài tập
Gọi số khối đồng vị còn lại là a. Ta có:
![]() \(\frac{(50.0,25 + 99,75.a)}{100} = 50,9975\) => a = 51
\(\frac{(50.0,25 + 99,75.a)}{100} = 50,9975\) => a = 51
Vậy số khối đồng vị còn lại củaVanadi là 51
>> Tham khảo thêm đáp án: Nguyên tử khối trung bình của vanadium (V) ...
Câu 8 trang 27 SGK Hóa 10 KNTT
Cấu hình electron của:
- Nguyên tử X: 1s22s22p63s23p64s1
- Nguyên tử Y: 1s22s22p63s23p4
a) Mỗi nguyên tử X và Y chứa bao nhiêu electron?
b) Hãy cho biết số hiệu nguyên tử của X và Y.
c) Lớp electron nào trong nguyên tử X và Y có mức năng lượng cao nhất?
d) Mỗi nguyên tử X và Y có bao nhiêu lớp electron, bao nhiêu phân lớp electron?
e) X và Y là nguyên tố kim loại, phi kim hay khí hiếm?
Hướng dẫn giải bài tập
a)
Nguyên tử X có 19 electron
Nguyên tử X có 16 electron
b)
Nguyên tử X có 19 electron => Nguyên tử X có số hiệu nguyên tử ZX = 19
Nguyên tử Y có 16 electron => Nguyên tử Y có số hiệu nguyên tử ZY = 16
c)
Trong nguyên tử X lớp electron ở mức năng lượng cao nhất là lớp N (n= 4)
Trong nguyên tử Y lớp electron ở mức năng lượng cao nhất là lớp M (n= 3)
d) Nguyên tử X có:
+ 4 lớp electron (n = 1, 2, 3, 4)
+ 6 phân lớp electron (gồm 1s, 2s, 2p, 3s, 3p, 4s)
Nguyên tử Y có:
+ 3 lớp electron (n= 1, 2, 3)
+ 5 phân lớp electron (gồm 1s, 2s, 2p, 3s, 3p)
e)
Nguyên tử X có 1 e lớp ngoài cùng (4s1)
=> X là nguyên tố kim loại.
Nguyên tử Y có 6 e lớp ngoài cùng (3s23p4)
=> Y là nguyên tố phi kim.
Câu 9 trang 27 SGK Hóa 10 KNTT
Nguyên tố X được dùng để chế tạo hợp kim nhẹ, bền, dùng trong nhiều lĩnh vực: hàng không, ô tô, xây dựng, hàng tiêu dùng,… Nguyên tố Y ở dạng YO43-, đóng vai trò quan trọng trong các phân tử sinh học như DNA và RNA. Các tế bào sống sử dụng YO43- để vận chuyển năng lượng. Nguyên tử của nguyên tố X có cấu hình electron kết thúc ở phân lớp 3p1. Nguyên tử nguyên tố Y có cấu hình electron kết thúc ở phân lớp 3p3. Viết cấu hình electron nguyên tử của X và Y. Tính số electron trong các nguyên tử X và Y. Nguyên tố X và Y có tính kim loại hay phi kim?
Hướng dẫn giải bài tập
Nguyên tử nguyên tố X có electron cuối cùng điền vào phân lớp 3p1
Cấu hình electron của X là: 1s22s22p63s23p1
=> X có 13 e và X là nguyên tố kim loại (vì có 3 e lớp ngoài cùng)
Nguyên tử nguyên tố Y có e cuối cùng điền vào phân lớp 3p3
Cấu hình electron của Y là: 1s22s22p63s23p3
=> Y có 15 e và Y là nguyên tố phi kim (vì có 5 e lớp ngoài cùng).
Câu 10 trang 27 SGK Hóa 10 KNTT
Nguyên tử của nguyên tố X có tổng số hạt cơ bản (proton, electron, neutron) là 49, trong đó số hạt không mang điện bằng 53,125% số hạt mang điện. Xác định điện tích hạt nhận, số proton, số electron, số neutron và số khối của X?
Hướng dẫn giải bài tập
Gọi số hạt proton, electron và neutron trong nguyên tử X lần lượt là P, E, N (Z = P = E)
Ta có theo đầu bài:
Nguyên tử của nguyên tố X có tổng số hạt cơ bản là 49:
=> 2Z + N = 49 (1)
Lại có, số hạt không mang điện bằng 53,125% số hạt mang điện:
=> N = 2Z .53,125/100 (2)
Giải phương trình (1) và (2) ta được:
=> Z = 16 = P = E
N =17
Số khối của nguyên tử X là: Z + N = 16 + 17 = 33
Vậy nguyên tử nguyên tố X có: điện tích hạt nhân là 16+, 16 proton, 16 electron, 17 neutron và có số khối là 33.
>> Tham khảo thêm đáp án: Nguyên tử của nguyên tố X có tổng số hạt ....
>> Bài tiếp theo: Giải Hóa 10 Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học
-------------------------------
Hy vọng thông qua các nội dung hướng dẫn giải, bạn đọc sẽ nắm được phương pháp, cũng như kĩ năng để trả lời các nội dung câu hỏi đó, từ đó vận dụng trả lời các câu hỏi bài tập tương tự. Mời các bạn tham khảo chi tiết nội dung dưới đây.
Như vậy, VnDoc.com đã gửi tới các bạn Giải Hóa 10 Bài 4: Ôn tập chương 1 KNTT. Ngoài ra, các em học sinh có thể tham khảo môn Lý 10 Kết nối tri thức và Toán 10 kết nối tri thức, Sinh 10 Kết nối tri thức đầy đủ khác.
Hãy tham gia ngay chuyên mục Hỏi đáp các lớp của VnDoc. Đây là nơi kết nối học tập giữa các bạn học sinh với nhau, giúp nhau cùng tiến bộ trong học tập. Các bạn học sinh có thể đặt câu hỏi tại đây:
- Truy cập ngay: Hỏi - Đáp học tập
Hỏi đáp, thảo luận và giao lưu về Toán, Văn, Hóa, Lý, Sinh, Tiếng Anh,... từ Tiểu Học đến Trung học phổ thông nhanh nhất, chính xác nhất.








