Giải SBT Hóa học 10 Kết nối tri thức bài 17
VnDoc xin giới thiệu bài Giải SBT Hóa học 10 bài 17: Biến thiên enthalpy trong phản ứng hóa học sách Kết nối tri thức được biên soạn hướng dẫn bạn đọc trả lời các nội câu hỏi bài tập môn Hóa 10 Kết nối tri thức. Hy vọng thông qua nội dung tài liệu, sẽ giúp bạn đọc hoàn thành tốt các nội dung câu hỏi.
Bài: Biến thiên enthalpy trong phản ứng hóa học
Nhận biết
Bài 17.1 trang 45 SBT Hóa học 10: Phản ứng nào sau đây là phản ứng tỏa nhiệt?
A. Phản ứng nhiệt phân muối KNO3.
B. Phản ứng phân hủy khí NH3.
C. Phản ứng oxi hóa glucose trong cơ thể.
D. Phản ứng hòa tan NH4Cl trong nước.
Lời giải
Đáp án đúng là: C
Oxi hóa glucose thành CO2 và H2O, tương tự phản ứng đốt cháy glucose là phản ứng tỏa nhiệt.
Bài 17.2 trang 45 SBT Hóa học 10: Phản ứng nào sau đây có thể tự xảy ra ở điều kiện thường?
A. Phản ứng nhiệt phân Cu(OH)2
B. Phản ứng giữa H2 và O2 trong không khí.
C. Phản ứng giữa Zn và dung dịch H2SO4
D. Phản ứng đốt cháy cồn.
Lời giải
Đáp án đúng là: C
Phản ứng giữa Zn và dung dịch H2SO4 có thể tự xảy ra ở điều kiện thường
Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g)
Các phản ứng còn lại cần cung cấp nhiệt thì phản ứng mới xảy ra.
Bài 17.3 trang 45 SBT Hóa học 10: Cho phản ứng hóa học xảy ra ở điều kiện chuẩn sau:
2NO2(g) (đỏ nâu) → N2O4(g) (không màu)
Biết NO2 và N2O4 có ![]() tương ứng là 33,18 kJ/mol và 9,16 kJ/mol. Điều này chứng tỏ phản ứng
tương ứng là 33,18 kJ/mol và 9,16 kJ/mol. Điều này chứng tỏ phản ứng
A. tỏa nhiệt, NO2 bền vững hơn N2O4.
B. thu nhiệt, NO2 bền vững hơn N2O4.
C. tỏa nhiệt, N2O4 bền vững hơn NO2.
D. thu nhiệt, N2O4 bền vững hơn NO2.
Lời giải
Đáp án đúng là: C
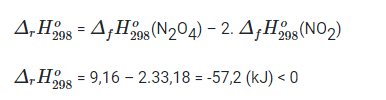
Phản ứng tỏa nhiệt, N2O4 bền hơn NO2
Bài 17.4 trang 45 SBT Hóa học 10: Nung KNO3 lên 550oC xảy ra phản ứng:
KNO3(s) → KNO2(s) + 1/2 O2(g) ∆H
Phản ứng nhiệt phân KNO3 là
A. tỏa nhiệt, có ∆H < 0
B. thu nhiệt, có ∆H > 0
C. tỏa nhiệt, có ∆H > 0
D. thu nhiệt, có ∆H < 0
Lời giải
Đáp án đúng là: B
Phản ứng nhiệt phân KNO3 chỉ xảy ra ở nhiệt độ cao, khi cung cấp nhiệt vào, đó là phản ứng thu nhiệt, theo quy ước ∆H > 0
Bài 17.5 trang 46 SBT Hóa học 10: Nung nóng hai ống nghiệm chứa NaHCO3 và P, xảy ra các phản ứng sau:
2NaHCO3(s) → Na2CO3(s) + CO2(g) + H2O(g) (1)
Khi ngừng đun nóng, phản ứng (1) dừng lại còn phản ứng (2) tiếp tục xảy ra, chứng tỏ
A. phản ứng (1) tỏa nhiệt, phản ứng (2) thu nhiệt.
B. Phản ứng (1) thu nhiệt, phản ứng (2) tỏa nhiệt.
C. cả 2 phản ứng đều tỏa nhiệt.
D. cả 2 phản ứng đều thu nhiệt.
Lời giải
Đáp án đúng là: B
Khi ngừng đun nóng, phản ứng (1) dừng lại, chỉ còn phản ứng (2) tiếp tục xảy ra, chứng tỏ phản ứng (1) thu nhiệt, phản ứng (2) tỏa nhiệt.
Thông hiểu
Bài 17.6 trang 46 SBT Hóa học 10: Tiến hành quá trình ozone hóa 100 g oxi theo phản ứng sau:
3O2 (oxygen) → 2O3 (ozone)
Hỗn hợp thu được có chứa 24% ozone về khối lượng, tiêu tốn 71,2 kJ. Nhiệt tạo thành ![]() của ozone (kJ/mol) có giá trị là
của ozone (kJ/mol) có giá trị là
A. 142,4
B. 284,8
C. -142,4
D. -284,8
Lời giải
Đáp án đúng là: A

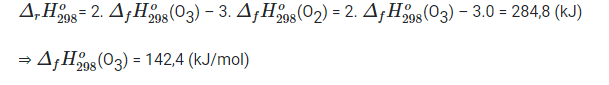
Bài 17.7 trang 46 SBT Hóa học 10: Cho phản ứng hydrogen hóa ethylene sau:
H2C=CH2 (g) + H2 (g) → H3C-CH3 (g)
Biết năng lượng liên kết trong các chất cho trong bảng sau:
|
Liên kết |
Phân tử |
Eb (kJ/mol) |
Liên kết |
Phân tử |
Eb (kJ/mol) |
|
C=C |
C2H4 |
612 |
C-C |
C2H6 |
346 |
|
C-H |
C2H4 |
418 |
C-H |
C2H6 |
418 |
|
H-H |
H2 |
436 |
|
|
|
Biến thiên enthalpy (kJ) của phản ứng có giá trị là
A. 134
B. -134
C. 478
D. 284
Lời giải
Đáp án đúng là: B
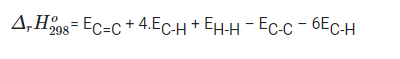
= EC=C + EH-H – EC-C – 2EC-H
= 612 + 436 – 346 – 2.418 = -134 (kJ)
Bài 17.8 trang 46 SBT Hóa học 10: Cho phương trình phản ứng sau:
2H2(g) + O2(g) → 2H2O(l) ∆H = -572 kJ
Khi cho 2 g khí H2 tác dụng hoàn toàn với 32 g khí O2 thì phản ứng
A. tỏa ra nhiệt lượng 286 kJ.
B. thu vào nhiệt lượng 286 kJ.
C. tỏa ra nhiệt lượng 572 kJ.
D. thu vào nhiệt lượng 572 kJ.
Lời giải
Đáp án đúng là: A
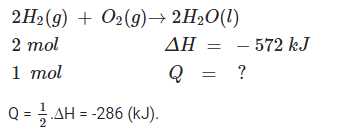
Bài 17.9 trang 47 SBT Hóa học 10: Tính biến thiên enthalpy theo các phương trình phản ứng sau, biết nhiệt sinh của NH3 bằng -46 kJ/mol.
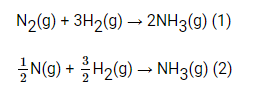
So sánh ∆H (1) và ∆H (2). Khi tổng hợp được 1 tấn NH3 thì nhiệt lượng tỏa ra hay thu vào là bao nhiêu? Tính theo hai phương trình phản ứng trên thì kết quả thu được giống nhau hay khác nhau.
Lời giải
Áp dụng công thức tính:
![]()
Chú ý: Nhiệt tạo thành (nhiệt sinh) của đơn chất bằng 0
∆H (1) = 2.(-46) – 0 – 0 = -92 (kJ).
∆H (2) = (-46) – 0 – 0 = -46 (kJ).
Phản ứng tỏa nhiệt và ∆H (1) = 2.∆H (2)
Khi tông hợp 17 gam NH3 thì tỏa ra 46 kJ nhiệt lượng.
⇒ Khi tổng hợp 1 tấn NH3 thì nhiệt lượng tỏa ra 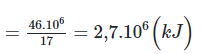
Tính theo 2 phương trình phản ứng đều ra kết quả giống nhau.
Bài 17.10 trang 47 SBT Hóa học 10: Cho các phản ứng sau:
CaCO3(s) → CaO + CO2(g) (1)
C(graphite) + O2 → CO2(g) (2)
Tính biến thiên enthalpy của các phản ứng trên. (Biết nhiệt sinh (kJ/mol) của CaCO3, CaO và CO2 lần lượt là -1 207, -635 và -393,5).
Lời giải
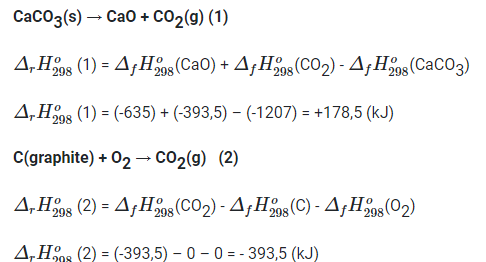
Bài 17.11 trang 47 SBT Hóa học 10: Cho các phản ứng sau và biến thiên enthalpy chuẩn:
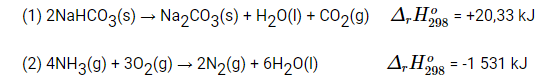
Phản ứng nào tỏa nhiệt? Phản ứng nào thu nhiệt?
Lời giải
Phản ứng (1) có ![]() = +20,33 kJ > 0 là phản ứng thu nhiệt
= +20,33 kJ > 0 là phản ứng thu nhiệt
Phản ứng (2) có ![]() = -1 531 kJ < 0 là phản ứng tỏa nhiệt
= -1 531 kJ < 0 là phản ứng tỏa nhiệt
Vận dụng
Bài 17.12 trang 47 SBT Hóa học 10: Phản ứng giữa khí nitrogen và oxygen chỉ xảy ra ở nhiệt độ cao (3 000oC) hoặc nhờ tia lửa điện: N2(g) + O2(g) → 2NO(g)
b) Phản ứng trên tỏa nhiệt hay thu nhiệt?
b) Bằng kiến thức về năng lượng liên kết trong phân tử các chất, hãy giải thích vì sao phản ứng trên khó xảy ra.
Lời giải
a) Phản ứng trên chỉ xảy ra khi nhận nhiệt bên ngoài, đó là phản ứng thu nhiệt.
b) Do năng lượng liên kết trong phân tử các chất phản ứng rất lớn (N2: 945 kJ/mol, O2: 494 kJ/mol) so với sản phẩm (NO: 607 kJ/mol) nên phản ứng trên khó xảy ra.
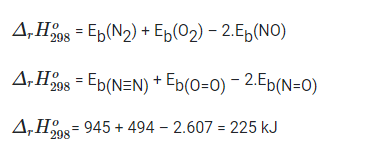
>>>> Bài tiếp theo: Giải SBT Hóa học 10 Kết nối tri thức bài 18
Như vậy, VnDoc đã gửi tới các bạn Giải SBT Hóa học 10 bài 17: Biến thiên enthalpy trong phản ứng hóa học. Ngoài ra, các em học sinh có thể tham khảo môn Ngữ văn 10 Kết nối tri thức tập 1, Vật Lý 10 Kết nối tri thức và Toán 10 Kết nối tri thức tập 1, Toán 10 Kết nối tri thức tập 2, Sinh 10 Kết nối tri thức đầy đủ khác.









