Giải SBT Hóa học 10 Chân trời sáng tạo bài: Ôn tập chương 1
Với nội dung bài Giải sách bài tập Hóa học 10 bài: Ôn tập chương 1 sách Chân trời sáng tạo hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hoá học 10.
Bài: Ôn tập chương 1
Bài OT 1.1 trang 17 SBT Hóa học 10: Nguyên tử là phần tử nhỏ nhất của chất và
A. không mang điện
B. mang điện tích dương
C. mang điện tích âm
D. có thể mang điện hoặc không mang điện
Lời giải:
Đáp án đúng là: A
Nguyên tử là phần tử nhỏ nhất của chất và không mang điện.
Bài OT 1.2 trang 17 SBT Hóa học 10: Phát biểu nào sau đây không đúng?
A. Chỉ có hạt nhân nguyên tử oxygen mới có 8 proton.
B. Chỉ có hạt nhân nguyên tử oxygen mới có 8 neutron
C. Chỉ có nguyên tử oxygen mới có 8 electron.
D. Cả A và C
Lời giải:
Đáp án đúng là: B
Một số nguyên tử khác nhau nhưng có số neutron giống nhau.
Bài OT 1.3 trang 17 SBT Hóa học 10: Số hiệu nguyên tử cho biết
A. Số proton trong hạt nhân nguyên tử hoặc số đơn vị điện tích hạt nhân nguyên tử.
B. Số electron trong lớp vỏ nguyên tử.
C. Số thứ tự của nguyên tố trong bảng tuần hoàn
D. Cả A, B và C đều đúng
Lời giải:
Đáp án đúng là: D
Số hiệu nguyên tử = số đơn vị điện tích hạt nhân = số electron = số proton = số thứ tự của nguyên tố trong bảng tuần hoàn.
Bài OT 1.4 trang 17 SBT Hóa học 10: Cấu hình electron nào sau đây là của nguyên tử fluorine (Z = 9)?
A. 1s22s22p3
B. 1s22s22p4
C. 1s22s32p4
D. 1s22s22p5
Lời giải:
Đáp án đúng là: D
Fluorine (Z = 9), cấu hình electron: 1s22s22p5.
Bài OT 1.5 trang 17 SBT Hóa học 10: Nguyên tử của nguyên tố phosphorus (Z = 15) có số electron độc thân là
A. 1
B. 2
C. 3
D. 4
Lời giải:
Đáp án đúng là: C
Cấu hình electron của P (Z = 15): 1s22s22p63s23p3.
Sự phân bố các electron vào AO:
![]()
Nguyên tử của nguyên tố phosphorus (Z = 15) có số electron độc thân là 3.
Bài OT 1.6 trang 17 SBT Hóa học 10: Trong tự nhiên, bromine có 2 đồng vị ![]() \(_{35}^{79}Br\) có hàm lượng 50,7% và
\(_{35}^{79}Br\) có hàm lượng 50,7% và ![]() \(_{35}^{81}Br\) có hàm lượng 49,3%. Tính nguyên tử khối trung bình của bromine.
\(_{35}^{81}Br\) có hàm lượng 49,3%. Tính nguyên tử khối trung bình của bromine.
Lời giải:
Nguyên tử khối trung bình của bromine là:
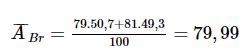
Bài OT 1.7 trang 17 SBT Hóa học 10: Lithium trong tự nhiên có 2 đồng vị là ![]() \(_{7}^{3}Li\) và
\(_{7}^{3}Li\) và ![]() \(_{3}^{6}Li\) . Nguyên tử khối trung bình của lithium là 6,94. Tính thành phần phần trăm của mỗi đồng vị lithium trong tự nhiên.
\(_{3}^{6}Li\) . Nguyên tử khối trung bình của lithium là 6,94. Tính thành phần phần trăm của mỗi đồng vị lithium trong tự nhiên.
Lời giải:
Gọi % số nguyên tử của mỗi đồng vị ![]() \(_{7}^{3}Li\) và
\(_{7}^{3}Li\) và ![]() \(_{3}^{6}Li\) lần lượt là x và y.
\(_{3}^{6}Li\) lần lượt là x và y.
Theo bài ra, ta có hệ phương trình:
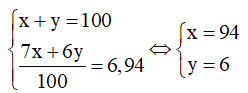
Vậy % số nguyên tử của mỗi đồng vị và lần lượt là 94% và 6%.
Giải SBT Hoá học 10 trang 18
Bài OT 1.8 trang 18 SBT Hóa học 10: Điện tích của electron là – 1,602.10-19C (coulomb). Tính điện tích của hạt nhân nguyên tử carbon theo đơn vị coulomb.
Lời giải:
Điện tích của proton là: 1,602.10-19C
Hạt nhân nguyên tử carbon có 6 proton.
Điện tích hạt nhân nguyên tử carbon là: 6.1,602.10-19 = 9,612.10-19C.
Bài OT 1.9 trang 18 SBT Hóa học 10: Hợp chất Y có công thức MX2 (là hợp chất được sử dụng làm cơ chế đánh lửa bằng bánh xe trong các dạng súng cổ), trong đó M chiếm 46,67% về khối lượng. Trong hạt nhân M có số neutron nhiều hơn số proton là 4 hạt. Trong hạt nhân nguyên tử X, số neutron bằng số proton. Tổng số proton trong MX2 là 58.
a. Tìm AM và AX
b. Xác định công thức phân tử của MX2.
Lời giải:
a) Gọi số proton và neutron của M lần lượt là p và n; số proton và neutron của X lần lượt là p’ và n’.
M chiếm 46,67% về khối lượng nên:
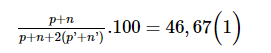
Trong hạt nhân M có số neutron nhiều hơn số proton là 4 hạt nên: n = p + 4 (2)
Trong hạt nhân nguyên tử X, số neutron bằng số proton nên: p’ = n’ (3)
Tổng số proton trong MX2 là 58 nên: p + 2p’ = 58 (4)
Thế (2) và (3) vào (1) được:
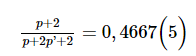
Từ (4) và (5) có p = 26; p’ = 16, suy ra n = 30, n’ = 16.
Vậy AM = p + n = 26 + 30 = 56.
Ax = p’ + n’ = 16 + 16 = 32.
b) M là Fe, X là S, công thức phân tử MX2 là FeS2.
Bài OT 1.10 trang 18 SBT Hóa học 10: Hợp chất có công thức phân tử M2X (được ứng dụng trong sản xuất xi măng, phân bón) có tổng số hạt là 140. Trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 44. Số khối của nguyên tử M lớn hơn số khối của nguyên tử X là 23. Tổng số hạt trong nguyên tử M nhiều hơn trong nguyên tử X là 34. Viết cấu hình electron của các nguyên tử M và X. Viết công thức phân tử của hợp chất M2X.
Lời giải:
Gọi số proton và neutron của M lần lượt là pM và nM; số proton và neutron của X lần lượt là pX và nX.
Hợp chất M2X có tổng số hạt là 140 nên:
2(2pM + nM) + 2pX + nX = 140 hay 4pM + 2pX + 2nM + nX = 140(1)
Trong M2X, số hạt mang điện nhiều hơn số hạt không mang điện là 44 nên:
(4pM + 2pX) – (2nM + nX) = 44(2)
Từ (1) và (2) giải hệ phương trình được: 4pM + 2pX = 92 (3) và 2nM + nX = 48
Số khối của nguyên tử M lớn hơn số khối của nguyên tử X là 23 nên:
(pM + nM) – (pX + nX) = 23 hay (pM – pX) + (nM – nX) = 23 (4)
Tổng số hạt trong nguyên tử M nhiều hơn trong nguyên tử X là 34 nên:
(2pM + nM) – (2pX + nX) = 34 hay 2(pM – pX) + (nM – nX) = 34 (5)
Từ (4) và (5) giải hệ phương trình được pM – pX = 11 (6); nM – nX = 12.
Kết hợp (3) và (6) được pM = 19; pX = 8.
pM = 19 ⇒ ZM = 19, cấu hình electron của M là: 1s22s22p63s23p64s1.
pX = 8 ⇒ ZX = 8, cấu hình electron của X là: 1s22s22p4.
Công thức phân tử của hợp chất M2X là K2O.
>>>> Bài tiếp theo: Giải SBT Hóa học 10 Chân trời sáng tạo bài 5
Như vậy, VnDoc đã gửi tới các bạn Giải Hóa học 10 bài: Ôn tập chương 1. Ngoài ra, các em học sinh có thể tham khảo môn Ngữ văn 10 Kết nối tri thức tập 1, Vật Lý 10 Kết nối tri thức và Toán 10 Kết nối tri thức tập 1, Toán 10 Kết nối tri thức tập 2, Sinh 10 Kết nối tri thức đầy đủ khác.









