Chứng minh H2SO4 có tính oxi hóa mạnh
Chúng tôi xin giới thiệu bài Chứng minh H2SO4 có tính oxi hóa mạnh được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Chứng minh H2SO4 có tính oxi hóa mạnh
Câu hỏi: chứng minh H2SO4 có tính oxi hóa mạnh
Lời giải:
- H2SO4 loãng thể hiện tính oxh khi giải phóng H2.
- H2SO4 đặc thể hiện tính oxh khi giải phóng spk.
- PT thể hiện tính oxi hóa của cả 2 loại axit:
H2SO4+ Zn→ZnSO4+H2↑
2H2SO4 đ + Zn→ZnSO4+SO2↑+2H2O
- Công thức hóa học: H2SO4H2SO4
Các dạng của Axit sunfuric
- Axit sunfuric được sử dụng với những mục đích khác nhau vì vậy sẽ tồn tại ở các dạng khác nhau có thể kể đến như là:
+ Axit sunfuric loãng dùng trong phòng thí nghiệm thường chỉ có 10%
+ Dùng cho ắc quy khoảng 33,5%
+ Hàm lượng 62,18% là axit được dùng để sản xuất phân bón
+ 77,67% được dùng trong tháp sản xuất hay axit glover
+ 98% là axit đậm đặc
I) Axit Sunfuric đặc
1) Tính chất vật lí
- Là một axit mạnh
- Tính háo nước: H2SO4H2SO4 đặc hấp thụ mạnh nước, nước từ các hợp chất gluxit cũng được nó hấp thụ.
- Da thị tiếp xúc với axit sunfuric đặc sẽ bị bỏng rất nặng, cần cẩn thận khi sử dụng và sản xuất axit sunfuric.
2) Tính chất hóa học
a) Tính axit mạnh:
Tác dụng với bazo, oxit bazo, muối tạo thành muối và nước.
b) Tính oxi hóa
Tác dụng với kim loại
- H2SO4(đ,n)H2SO4(đ,n) có tính oxh rất mạnh, trừ Au và Pt thì hầu hết đều bị oxh tạo ra muối (trong đó kim loại có hóa trị cao nhất) + nước + sản phẩm khử.
VD:
Mg+5H2SO4→4MgSO4+H2S+4H2OMg+5H2SO4→4MgSO4+H2S+4H2O
♦ Lưu ý: Nhôm, Sắt, Crom bị thụ động hóa trong axit sunfuric đặc nguội
Tác dụng với phi kim
2H2SO4+S→3SO2+2H2O2H2SO4+S→3SO2+2H2O
Tác dụng với các chất khử khác
2FeO+4H2SO4→Fe2(SO4)3+SO2+4H2O2FeO+4H2SO4→Fe2(SO4)3+SO2+4H2O
II) Axit Sunfuric loãng
1) Tính chất vật lí
- Chất lỏng, nhớt, nặng hơn nước, khó bay hơn
- Tính tan: tan vô hạn trong nước
♦ Lưu ý: Cho từ từ H2SO4H2SO4 đặc vào nước (không ngược lại) là cách pha loãng axit sunfuric đặc
2) Tính chất hóa học
- Là một axit mạnh nên có đầy đủ các tính chất hóa học chung của axit.
- Làm quỳ tím chuyển đỏ
- Tác dụng với tất cả các kim loại đứng trước hidro (trù Pb) tạo muối sunfat và khí hidro.
VD: Fe+H2SO4→FeSO4+H2Fe+H2SO4→FeSO4+H2.
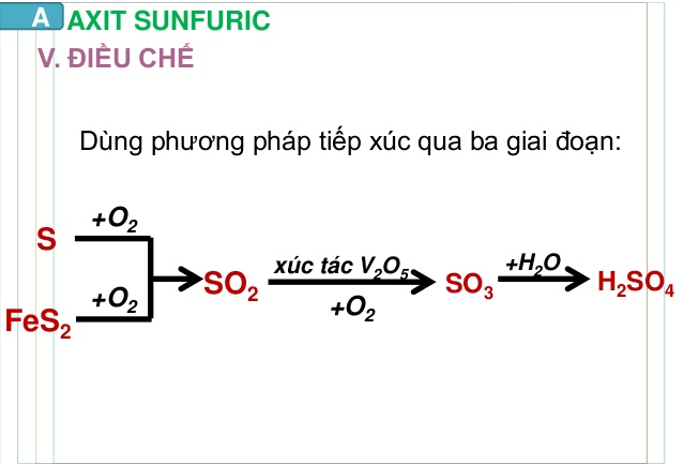
3) Sản xuất axit sunfuric
- Axit sunfuric được sản xuất trong công nghiệp bằng phương pháp tiếp xúc. Phương pháp này có 3 công đoạn chính:
Sản xuất lưu huỳnh đioxit (SO2)
- Phụ thuộc vào nguồn nguyên liệu có sẵn, người ta đi từ nguyên liệu ban đầu là lưu huỳnh hoặc pirit sắt FeS2
- Đốt cháy lưu huỳnh:
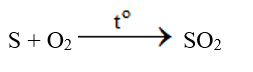
- Đốt quặng pirit sắt FeS2
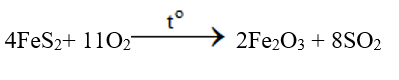
Sản xuất lưu huỳnh trioxit (SO3)
- Oxi hóa SO2 bằng khí oxi hoặc không khí dư ở nhiệt độ 450 – 500oC, chất xúc tác là vanađi(V) oxit V2O5:
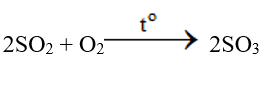
Hấp thụ SO3 bằng H2SO4
- Dùng H2SO4 98% hấp thụ SO3, được oleum H2SO4 .nSO3:
H2SO4 + nSO3 → H2SO4 .nSO3
- Sau đó dùng lượng nước thích hợp pha loãng oleum, được H2SO4 đặc:
H2SO4.nSO3 + nH2O → (n + 1) H2SO4
III) Những ứng dụng của axit sunfuric trong đời sống
Trong sản xuất công nghiệp
- Mỗi năm có khoảng 160 triệu tấn H2SO4, trong đó nổi bật khi được sử dụng trong các ngành sản xuất luyện kim 2%, phẩm nhuộm 2%, chất dẻo 5%, chất tẩy rửa 14%, giấy, sợi 8%…
+ Axit sunfuric được sử dụng rộng rãi trong quá trình sản xuất kim loại như sản xuất đồng, kẽm và dùng trong làm sạch bề mặt thép và dung dịch tẩy gỉ.
+ Ngoài ra, axit sunfuric còn được sử dụng để sản xuất nhôm sunfat (ví dụ như phèn làm giấy). Sản xuất các loại muối sunfat, tẩy rửa kim loại trước khi mạ, chế tạo thuốc nổ, chất dẻo, thuốc nhuộm, sản xuất dược phẩm.
+ Hỗn hợp axit với nước được dùng để làm chất điện giải trong hàng loạt các dạng ắc quy, axit chì…
Trong phòng thí nghiệm
- Điều chế các axít khác yếu hơn: HNO3. HCl.
Trong xử lý nước thải
- Sản xuất nhôm hidroxit là chất được sử dụng trong các nhà máy xử lý nước để lọc các tạp chất, cũng như cải thiện mùi vị của nước, trung hòa pH trong nước, và sử dụng để loại bỏ các ion Mg2+, Ca2+ có trong nước thải.
Trong sản xuất phân bón
- Axít sulfuric (60% sản lượng toàn thế giới) chủ yếu được sử dụng là trong sản xuất axít phốtphoric, là chất được sử dụng để sản xuất các loại phân photphate, canxi dihydrogen photphat, amoni photphate, và cũng dùng để sản xuất Amoni sunfat.
Ứng dụng khác của Axit sunfuric:
- Sản xuất nhôm sulfat, được biết đến như là phèn làm giấy. Nó có thể phản ứng với một lượng nhỏ xà phòng trên các sợi bột giấy nhão để tạo ra cacboxylat nhôm dạng giêlatin, nó giúp làm đông lại các sợi bột giấy thành bề mặt cứng của giấy.
Những lưu ý khi sử dụng Axit sunfuric
- Bạn cần biết được những nguy hiểm tiềm ẩn đối với dung dịch Axit này để có thể sử dụng nó một cách cách an toàn nhất.
+ Axit Sunfuric H2SO4 rất nguy hiểm, bắn vào da có thể gây bỏng nặng, bắn vào mắt có thể bị mù, các vật liệu bằng giấy, vải sẽ bị cháy nếu tiếp xúc với H2SO4
+ Khi đun nóng Axit Sunfuric sẽ xuất hiện khí SO2 và SO3. Đây là những loại khí rất độc hại.
+ Khi cần pha loãng Axit Sunfuric H2SO4 tuyệt đối không được cho nước vào axit trước mà Luôn luôn phải cho từ từ H2SO4 vào nước.
+ H2SO4 đặc hấp thụ cực kỳ mãnh liệt hơi ẩm vì thế là một chất làm khô tốt , áp suất hơi nước trên H2SO4 là 0,003mmHg.
+ Ở nhiệt độ 30 – 40 độ C, bắt đầu bốc khói và khi đun tiếp sẽ tạo ra hơi SO3. Bắt đầu sôi ở 290 độ C và nhiệt độ sẽ tăng nhanh cho tới khi ngừng giải phóng SO3. Hydrat còn lại chứa 98.3% H2SO4 và Sôi ở 338 độ C.
+ Khi làm lạnh sẽ chuyển thành dạng rắn, những tinh thể Axit Sunfuric H2SO4 nóng chảy ở 10,49 độ C. Tuy nhiên, axit lỏng dễ có thể chậm đông không hoá rắn ở dưới 0 độ C.
Biện pháp bảo quản và phòng ngừa
Đối với bảo quản
+ Lưu trữ Axit Sunfuric bằng bồn nhựa, phuy nhựa. Không được chứa trong bồn được làm bằng các chất liệu nhôm, thiếc, inox và kẽm bởi nó là một chất ăn mòn kim loại rất mạnh. Các bồn sắt lớn chưa H2SO4 đều phải tráng lớp PU. Đậy nắp kín, đặt nơi khô ráo, tránh xa nơi có chứa bazơ hay các chất khử.
+ Tránh để gần các kim loại, kim loại nhẹ, các chất có tính axít để tránh gây cháy nổ như HCl, acid nitric, acid phốtphoric,… gây nguy hiểm.
Biện pháp phòng ngừa
+ Đây là dạng hóa chất nguy hiểm, tiếp xúc da sẽ gây bỏng cháy nặng, vào mắt gây hỏng mắt vĩnh viễn cho nên phải tránh tiếp xúc trực tiếp, không được uống, hít vào.
+ Khi sử dụng hoặc bơm vào bồn chứa phải mặc quần áo bảo hộ để bảo vệ cơ thể, đeo mặt nạ chuyên dùng để bảo vệ mắt, vận chuyển trên đường phải sử dụng bồn chứa được cấp phép an toàn.
+ Không để axít chảy vào hệ thống thoát nước.
+ Nếu có sự cố rò rỉ phải cách li nơi nguy hiểm, những người không liên quan hoặc không mang bảo hộ thì không được bước vào nơi nguy hiểm.
+ Khi cần thiết thì có thể dùng thanh chắn nhựa hoặc rãnh an toàn để tránh axít tràn ra ngoài.
----------------------------------------