Giải Hóa 10 Bài 9: Quy tắc Octet Cánh diều
Giải Hóa 10 Cánh diều Bài 9: Quy tắc Octet
Giải Hóa 10 Bài 9: Quy tắc Octet Cánh diều được VnDoc biên soạn hướng dẫn bạn đọc trả lời các câu hỏi thảo luận, luyện tập và giải các bài tập SGK Hóa 10 Cánh diều bài 9. Hy vọng tài liệu sẽ giúp ích cho bạn đọc trong quá trình học tập, rèn luyện kĩ năng thao tác giải bài tập Hóa 10.
>> Bài trước đó: Giải Hóa 10 Bài 8: Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học Cánh diều
A. Câu hỏi thảo luận
Câu 1 trang 49 Hóa 10 Cánh diều
Cho biết nguyên tử các nguyên tố sau: Na (Z = 11), Cl (Z = 17), Ne (Z = 10), Ar (Z = 18). Những nguyên tử nào trong các nguyên tử trên có lớp electron ngoài cùng bền vững?
Hướng dẫn trả lời câu hỏi
Cấu hình electron nguyên tử của các nguyên tố lần lượt là:
Na (Z = 11): 1s22s22p63s1
Cl (Z = 17): 1s22s22p63s23p5
Ne (Z = 10): 1s22s22p6
Ar (Z = 18): 1s22s22p63s23p6
Nguyên tử Ne (Z = 10) và Ar (Z = 18) có lớp electron ngoài cùng bền vững (lớp electron ngoài cùng đã bão hòa với 8 electron).
Câu 2 trang 49 Hóa 10 Cánh diều
Oxygen có Z = 8, cho biết xu hướng cơ bản của nguyên tử oxygen khi hình thành liên kết hóa học. Hãy vẽ sơ đồ minh họa quá trình đó.
Hướng dẫn trả lời câu hỏi
Cấu hình electron O (Z = 8): 1s22s22p4
Oxygen có 6 electron lớp ngoài cùng có xu hướng nhận thêm 2 electron để đạt được lớp vỏ có 8 electron ở lớp ngoài cùng (như của khí hiếm Ar) khi hình thành liên kết hóa học.

B. Câu hỏi luyện tập
Luyện tập 1 trang 50 Hóa 10 Cánh diều
Tính phi kim được đặc trưng bằng khả năng nhận electron. Xu hướng cơ bản của nguyên tử O và F trong các phản ứng hóa học là nhường hay nhận bao nhiêu electron?
Hướng dẫn trả lời câu hỏi
O và F đều có tính phi kim ⇒ Xu hướng cơ bản của nguyên tử O và F trong các phản ứng hóa học là nhận electron.
+ Ta có: Cấu hình electron O (Z = 8): 1s22s22p4 ⇒ Nguyên tử O sẽ nhận thêm 2 electron để được lớp vỏ có 8 electron lớp ngoài cùng bền vững.
+ Ta có: Cấu hình electron F (Z = 9): 1s22s22p5 ⇒ Nguyên tử F sẽ nhận thêm 1 electron để được lớp vỏ có 8 electron lớp ngoài cùng bền vững
Luyện tập 2 trang 51 Hóa 10 Cánh diều
Hãy dự đoán xu hướng nhường, nhận electron của mỗi nguyên tử trong từng cặp nguyên tử sau. Vẽ sơ đồ (hoặc viết số electron theo lớp) quá trình các nguyên tử nhường, nhận electron để tạo ion.
a) K (Z = 19) và O (Z = 8)
b) Li (Z = 3) và F (Z = 9)
c) Mg (Z = 12) và P (Z = 15)
Hướng dẫn trả lời câu hỏi
a) Cấu hình electron K (Z = 19): 1s22s22p63s23p64s1. Vậy K có 1 electron lớp vỏ ngoài cùng. Nguyên tử K có xu hướng nhường đi 1 electron để trở thành ion mang điện tích dương, kí hiệu là K+.
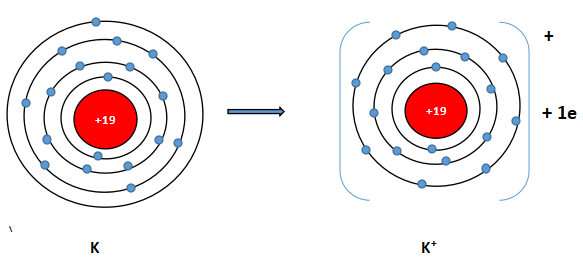
Cấu hình electron O (Z = 8): 1s22s22p4. Vậy O có 6 electron lớp vỏ ngoài cùng nên nguyên tử O có xu hướng nhận thêm 2 electron để trở thành ion mang điện tích âm, kí hiệu là O2-

b) Cấu hình electron Li (Z = 3): 1s22s1. Vậy Li có 1 electron lớp vỏ ngoài cùng. Nguyên tử Li có xu hướng nhường đi 1 electron để trở thành ion mang điện tích dương, kí hiệu là Li+.
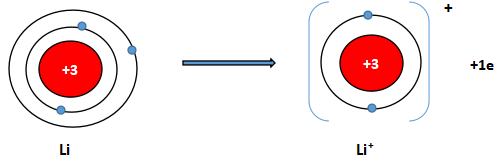
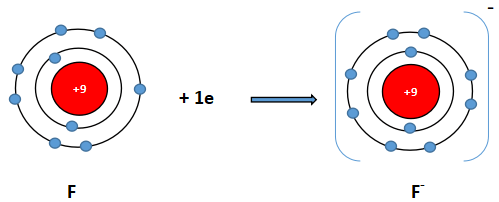
Cấu hình electron F (Z = 9): 1s22s22p5. Vậy F có 7 electron lớp vỏ ngoài cùng. Nguyên tử F có xu hướng nhận thêm 1 electron để trở thành ion mang điện tích âm, kí hiệu là F-.
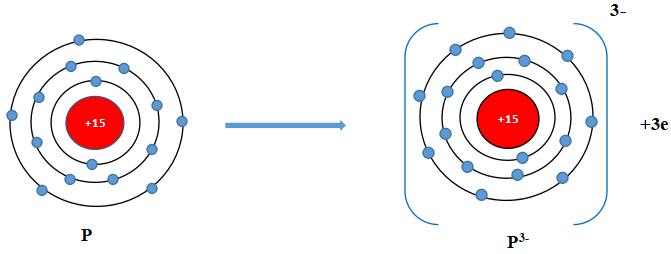
c) Cấu hình electron Mg (Z = 12): 1s22s22p63s2. Vậy Mg có 2 electron lớp vỏ ngoài cùng. Nguyên tử Mg có xu hướng nhường đi 2 electron để trở thành ion mang điện tích dương, kí hiệu là Mg2+.

+ Cấu hình electron P (Z = 15): 1s22s22p63s23p3. Vậy P có 5 electron lớp vỏ ngoài cùng. Nguyên tử P có xu hướng nhận thêm 3 electron để trở thành ion mang điện tích âm, kí hiệu là P3-.
Luyện tập 2 trang 51 Hóa 10 Cánh diều
Vì sao các nguyên tố thuộc chu kì 2 chỉ có tối đa 8 electron ở lớp ngoài cùng (thỏa mãn quy tắc 8 electron khi tham gia liên kết).
Hướng dẫn trả lời câu hỏi
Các nguyên tố thuộc chu kì 2, có 2 lớp electron. Lại có, lớp thứ 2 có 4 AO, mà mỗi AO có tối đa 2 electron nên các nguyên tố thuộc chu kì 2 chỉ có tối đa 8 electron.
C. Bài tập trang 52 Hóa 10 Cánh diều
Bài 1 trang 52 Hóa 10 Cánh diều
Nguyên tử nitrogen và nguyên tử nhôm có xu hướng nhận hay nhường lần lượt bao nhiêu electron để đạt được cấu hình electron bền vững?
A. Nhận 3 electron, nhường 3 electron.
B. Nhận 5 electron, nhường 5 electron.
C. Nhường 3 electron, nhận 3 electron.
D. Nhường 5 electron, nhận 5 electron.
Hướng dẫn giải bài tập
Đáp án A
- Nitrogen (Z = 7)
Cấu hình electron là: 1s22s22p3
Lớp ngoài cùng của nguyên tử nitrogen có 5 electron, nên nguyên tử nitrogen có xu hướng nhận thêm 3 electron để đạt được cấu hình electron bền vững (8 electron ở lớp ngoài cùng).
- Nhôm (Z = 13)
Cấu hình electron là: 1s22s22p63s23p1
Lớp ngoài cùng của nguyên tử nhôm có 3 electron, nên nguyên tử nhôm có xu hướng nhường đi 3 electron để đạt được cấu hình electron bền vững (8 electron ở lớp ngoài cùng).
Bài 2 trang 52 Hóa 10 Cánh diều
Nguyên tử nguyên tố nào sau đây có xu hướng nhường đi 1 electron khi hình thành liên kết hóa học?
| A. Boron | B. Potassium | C. Helium | D. Fluorine. |
Hướng dẫn giải bài tập
Đáp án B
Cấu hình electron potassium (Z = 19): 1s22s22p63s23p64s1
Potassium có 1 electron lớp ngoài cùng nên có xu hướng nhường đi 1 electron này khi hình thành liên kết hóa học.
Bài 3 trang 52 Hóa 10 Cánh diều
Xu hướng tạo lớp vỏ bền vững hơn của các nguyên tử thể hiện như thế nào trong các trường hợp sau đây?
a) Kim loại điển hình tác dụng với phi kim điển hình.
b) Phi kim tác dụng với phi kim.
Hướng dẫn giải bài tập
a) Trong trường hợp kim loại điển hình tác dụng với phi kim điển hình, các nguyên tử kim loại sẽ có xu hướng nhường electron còn các nguyên tử phi kim sẽ có xu hướng nhận electron để hình thành liên kết hóa học.
b) Trong trường hợp phi kim tác dụng với phi kim, hai nguyên tử phi kim thường có xu hướng góp chung electron. Sau khi hình thành liên kết mỗi nguyên tử phi kim sẽ có 8 electron lớp ngoài cùng, giống lớp vỏ bền vững của khí hiếm.
Bài 4 trang 52 Hóa 10 Cánh diều
Ở dạng đơn chất, sodium (Na) và chlorine (Cl) rất dễ tham gia các phản ứng hóa học, nhưng muối ăn được tạo nên từ hai nguyên tố này lại không dễ dàng tham gia các phản ứng mà có sự nhường hoặc nhận electron. Giải thích.
Hướng dẫn giải bài tập
Ở dạng đơn chất, sodium (Na) có cấu hình electron là 1s22s22p63s1. Na có 1 electron lớp ngoài cùng. Nguyên tử Na dễ dàng nhường đi 1 electron để tạo thành ion Na+
Ở dạng đơn chất, chlorine (Cl) có cấu hình electron là 1s22s22p63s23p5. Cl có 7 electron lớp ngoài cùng. Nguyên tử Cl dễ dàng nhận thêm 1 electron để tạo thành ion Cl-.
Trong hợp chất NaCl (muối ăn) cả Na+ và Cl- đều đã có cấu hình bền vững của khí hiếm (với 8 electron ở lớp ngoài cùng) nên không dễ dàng tham gia các phản ứng mà có sự nhường hoặc nhận electron.
Bài 5* trang 52 Hóa 10 Cánh diều
Cho một số hydrocarbon sau: H-C≡C-H, H2C=CH2 và H3C-CH3.
a) Những nguyên tử H và C nào trong các hydrocarbon trên thỏa mãn quy tắc octet?
Biết rằng mỗi gạch (-) trong các công thức trên biểu diễn hai electron hóa trị chung.
b) Một phân tử hydrocarbon có ba nguyên tử C và x nguyên tử H. Giá trị x lớn nhất có thể là bao nhiêu?
Hướng dẫn giải bài tập
a) Mỗi gạch trong các công thức H-C≡C-H, H2C=CH2 và H3C-CH3 biểu diễn hai electron hóa trị chung.
Do đó mỗi C đã đủ 8 electron ở lớp ngoài cùng; mỗi H đã đủ 2 electron ở lớp ngoài cùng (thõa mãn quy tắc octet).
b) Một phân tử hydrocarbon có ba nguyên tử C và x nguyên tử H.
Phân tử hydrocarbon có dạng: C3Hx
Số các nguyên tử có hoá trị ≥ 2 là 3 (tức 3 C) ⇒ tổng số electron hoá trị là 3.4 = 12.
Tổng số liên kết đơn giữa các nguyên tử có hoá trị ≥ 2 là: 3 – 1 = 2 ⇒ tổng số electron tham gia tạo liên kết là 2.2 = 4.
Số H tối đa: x = 12 – 4 = 8
>> Bài tiếp theo: Giải Hóa 10 bài 11: Liên kết ion
---------------------------------------
Như vậy, VnDoc.com đã gửi tới các bạn Giải Hóa 10 Bài 9: Quy tắc Octet Cánh diều. Ngoài ra, các em học sinh có thể tham khảo môn: Vật Lý 10 Cánh Diều và Toán 10 Cánh Diều Tập 1, Toán 10 Cánh Diều Tập 2, Sinh 10 Cánh Diều đầy đủ khác.
Hãy tham gia ngay chuyên mục Hỏi đáp các lớp của VnDoc. Đây là nơi kết nối học tập giữa các bạn học sinh với nhau, giúp nhau cùng tiến bộ trong học tập. Các bạn học sinh có thể đặt câu hỏi tại đây:
- Truy cập ngay: Hỏi - Đáp học tập
Hỏi đáp, thảo luận và giao lưu về Toán, Văn, Hóa, Lý, Sinh, Tiếng Anh,... từ Tiểu Học đến Trung học phổ thông nhanh nhất, chính xác nhất.









