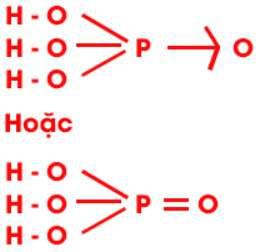
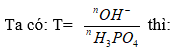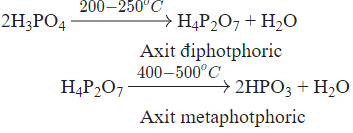Công thức cấu tạo của H3PO4
Công thức cấu tạo của H3PO4 được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Công thức cấu tạo của H3PO4
Câu hỏi: Công thức cấu tạo của H3PO4?
Trả lời:
Công thức cấu tạo H3PO4 là:
I. H3PO4 là gì?
- H3PO4 có tên gọi là axit phosphoric là chất rắn tinh thể không màu.
- Khối lượng riêng của H3PO4 là 1,87 g/cm3, nhiệt độ nóng chảy là 42,35oC (H3PO4, H2O có nhiệt độ nóng chảy là 29,32oC), nó phân hủy ở 2130C
- Ngoài ra, H3PO4 còn tan trong etanol, nước
II. Tính chất vật lý axit photphoric H3PO4
– Axit photphoric (H3PO4) còn gọi là axit orthophotphoric là chất rắn dạng tinh thể, trong suốt, không màu, dễ tan trong nước theo bất kì tỉ lệ nào.
– Axit photphoric thường dùng là dung dịch đặc, sánh, có nồng độ 85%”>85%.
III. Tính chất hóa học
Là axit trung bình yếu. Tuy nhiên, vẫn có đầy đủ các tính chất của 1 axit.
- Trong dung dịch H3PO4 phân li thuận nghịch theo 3 nấc:
H3PO4 ⇄ H+ + H2PO4-
H2PO4- ⇄ H+ + HPO42-
HPO42- ⇄ H+ + PO43-
Lưu ý: Trong dung dịch H3PO4 chứa đồng thời các ion H+, H2PO4-, HPO42-, PO43- và H3PO4 chưa phân li.
- Làm quỳ tím chuyển thành màu đỏ.
- Tác dụng với oxit bazơ → muối + H2O
2H3PO4 + 3Na2O → 2Na3PO4 + 3H2O
- Tác dụng với bazơ → muối + H2O .
KOH + H3PO4 → KH2PO4 + H2O
2KOH + H3PO4 → K2HPO4 + 2H2O
3KOH + H3PO4 → K3PO4 + 3H2O
Chú ý: Tùy theo tỉ lệ phản ứng có thể tạo thành các muối khác nhau:
+ T < hoặc = 1 → muối H2PO4-
+ T = 2 → HPO42-
+ 1 < T <2 → 2 muối: H2PO4- và HPO42-
+ 2 < T <3 → 2 muối: HPO42- và PO43-
+ T > hoặc = 3 → PO43-
- Tác dụng với kim loại đứng trước H → muối + H2
2H3PO4 + 3Mg → Mg3(PO4)2 + 3H2
- Tác dụng với muối → muối mới + axit mới
+ Điều kiện: chất sản phẩm phải có chất kết tủa.
H3PO4 + 3AgNO3 → 3HNO3 + Ag3PO4
Trong H3PO4, P có mức oxi hóa +5 là mức oxi hóa cao nhất nhưng H3PO4 không có tính oxi hóa như HNO 3 vì nguyên tử P có bán kính lớn hơn so với bán kính của N → mật độ điện dương trên P nhỏ → khả năng nhận e kém.
Các phản ứng do tác dụng của nhiệt
Lưu ý: Axit photphorơ H3PO3 là axit 2 lần axit.
IV. Ứng dụng
Muối photphat và công dụng chung
- Axit photphoric đóng vai trò là cơ sở cho sự hình thành phốt phát, được sử dụng làm phân bón vì phốt pho là chất dinh dưỡng chính của thực vật.
- Nó đã được sử dụng trong điều trị ngộ độc chì và các điều kiện khác trong đó cần có lượng phốt phát đáng kể và sản xuất nhiễm toan nhẹ.
- Nó được sử dụng để kiểm soát độ pH của đường tiết niệu của chồn và chi phí để tránh hình thành sỏi thận.
- Axit photphoric tạo ra muối Na2HPO4 và NaH2PO4 tạo thành một hệ thống đệm cho pH với pKa là 6,8. Hệ thống điều hòa pH này có ở người, có tầm quan trọng trong việc điều chỉnh pH nội bào, cũng như trong việc quản lý nồng độ hydro trong ống lượn xa và người thu thập nephron..
- Nó được sử dụng trong việc loại bỏ lớp oxit sắt bị mốc tích tụ trên kim loại này. Axit photphoric tạo thành phốt phát sắt có thể dễ dàng loại bỏ khỏi bề mặt kim loại. Nó cũng được sử dụng trong đánh bóng điện bằng nhôm và là một tác nhân liên kết của các sản phẩm chịu lửa như alumina và magnesia.
Công nghiệp
- Axit photphoric được dự định là một tác nhân xúc tác trong sản xuất nylon và xăng. Nó được sử dụng như một chất khử nước trong khắc thạch bản, trong sản xuất thuốc nhuộm để sử dụng trong ngành dệt, trong quá trình đông tụ mủ trong ngành công nghiệp cao su và trong quá trình tinh chế hydro peroxide.
- Axit được sử dụng làm phụ gia trong nước ngọt, do đó góp phần tạo nên hương vị của nó. Pha loãng được áp dụng trong quá trình tinh chế đường. Nó cũng hoạt động như một hệ thống đệm trong việc điều chế giăm bông, gelatin và kháng sinh.
- Tham gia vào sự phát triển của chất tẩy rửa, trong xúc tác axit của sản xuất acetylene.
- Nó được sử dụng như một chất axit trong thức ăn cân bằng cho ngành chăn nuôi và vật nuôi. Ngành công nghiệp dược phẩm sử dụng nó trong sản xuất thuốc chống nôn. Nó cũng được sử dụng trong hỗn hợp để làm nhựa đường để lát nền và sửa chữa các vết nứt.
- Axit photphoric hoạt động như một chất xúc tác trong phản ứng hydrat hóa của anken để tạo ra rượu, chủ yếu là ethanol. Ngoài ra, nó được sử dụng để xác định carbon hữu cơ trong đất.
Nha khoa
Nó được sử dụng bởi các nha sĩ để làm sạch và dưỡng bề mặt răng trước khi đặt các giá đỡ nha khoa. Nó cũng tìm thấy sử dụng trong làm trắng răng và trong việc loại bỏ các mảng bám răng. Ngoài ra, nó được sử dụng trong sản xuất chất kết dính cho phục hình răng.
Mỹ phẩm
Axit photphoric được sử dụng để điều chỉnh độ pH trong việc chuẩn bị các sản phẩm mỹ phẩm và chăm sóc da. Nó được sử dụng như một tác nhân oxy hóa hóa học để sản xuất than hoạt tính.
V. Điều chế
Trong phòng thí nghiệm
- Hóa chất: P và axit HNO3 đặc nóng
- PTHH:
Trong công nghiệp:
(1) Sử dụng quặng apatit và axit sunfuric đặc:
Ca3(PO4)2 + 3H2SO4 đặc → 3CaSO4 + 2H3PO4
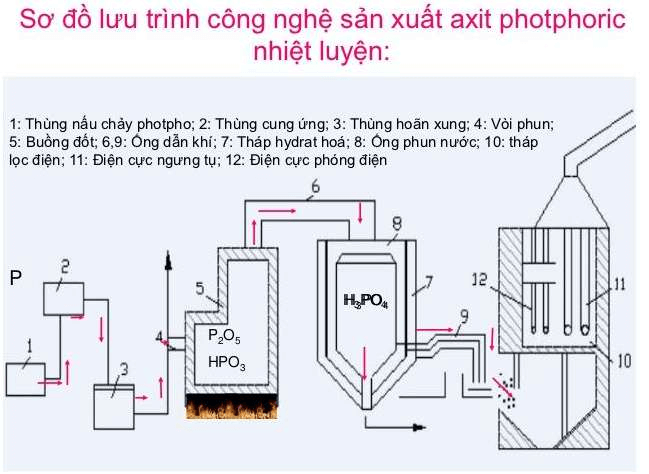
- Sơ đồ sản xuất H3PO4:
(2) Để điều chế H3PO4 với độ tinh khiết cao ta dùng sơ đồ: P → P2O5 → H3PO4
P2O5 + 3H2O → 2H3PO4
----------------------------------------
Trên đây VnDoc đã giới thiệu tới các bạn nội dung bài Công thức cấu tạo của H3PO4. Để có kết quả học tập tốt và hiệu quả hơn, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Hóa học 10, Chuyên đề Vật Lý 10, Chuyên đề Hóa học 10, Giải bài tập Toán 10. Tài liệu học tập lớp 10 mà VnDoc tổng hợp biên soạn và đăng tải.