Trắc nghiệm chương 6: Nhóm Oxi, Lưu huỳnh phần 7
Chuyên đề Hóa học lớp 10: Trắc nghiệm chương 6: Nhóm Oxi, Lưu huỳnh phần 7 được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Bài tập trắc nghiệm chương 6
Bài 1: Phương trình hóa học nào sau đây là sai?
A. 2Fe + 3H2SO4 → Fe2(SO4)3 + 3H2
B. 2Na + 2HCl → 2NaCl + H2
C. FeS + H2SO4 (loãng) → FeSO4 + H2S
D. 2Cr + 3Cl2 → 2CrCl3.
Hướng dẫn giải:
Đáp án A.
Fe + H2SO4 → FeSO4 + H2
Bài 2: Khi làm thí nghiệm với H2SO4 đặc, nóng thường sinh ra khí SO2. Để hạn chế tốt nhất khí SO2 thoát ra gây ô nhiễm môi trường, người ta nút ống nghiệm bằng bông tẩm dung dịch nào sau đây?
A. Giấm ăn. B. Muối ăn. C. Cồn. D. Xút.
Hướng dẫn giải:
Đáp án D.
2NaOH + SO2 → Na2SO3 + H2O
Bài 3: Hấp thụ V lít SO2 (đktc) vào 300 ml dung dịch Ba(OH)2 1M thu được 21,7g kết tủa. Tính V
A. 2,24 B. 1,12 C. 11,2 D. A & C
Hướng dẫn giải:
Đáp án D.
Trường hợp 1: Ba(OH)2 dư, SO2 hết , nBaSO3 = nSO2
Ba(OH)2 + SO2 → BaSO3 ↓+ H2O
0,1 ← 0,1
→ VSO2 = 0,1. 22,4 = 2,24 lít
Trường hợp 2: Ba(OH)2 hết, SO2 dư nhưng không hòa tan hết kết tủa (kết tủa chỉ tan một phần)
Ba(OH)2 + SO2 → BaSO3 ↓+ H2O
0,1 0,1 ← 0,1
Ba(OH)2 + 2SO2 → Ba(HSO3)2
( 0,3 – 0,1) → 0,4
→ nSO2 = 0,1 + 0,4 = 0,5 mol
→ VSO2 = 0,5. 22,4 = 11,2lít
Bài 4: Tỉ khối của hỗn hợp X gồm oxi và ozon so với hiđro là 18. Phần trăm thể tích của oxi và ozon có trong hỗn hợp X lần lượt là:
A. 25% và 75%
B. 30% và 70%
C. 50% và 50%
D.75% và 25%
Hướng dẫn giải:
Đáp án D
Coi số mol hỗn hợp X = 1 mol.
nO2 = x, nO3 = y (mol)
x + y = 1
32x + 48y = 1.18.2
⇒ x = 0,75, y = 0,25 (mol)
⇒ %VO2 =75%, %VO3 = 25%
Bài 5: Hỗn hợp X gồm hai khí SO2 và CO2 có tỉ khối đối với H2 là 27. Thành phần % theo khối lượng của SO2 là:
A. 35,5% B. 59,26% C. 40% D. 50%
Hướng dẫn giải
Đáp án D
Coi số mol hỗn hợp X = 1 mol.
nSO2 = x,nCO2 = y (mol)
x + y = 1
64x + 44y = 1.27.2
⇒ x = y = 05 (mol)
⇒ %VO2 = %VO3= 50%
Bài 6: Axit sunfuric đặc không được dùng để làm khô khí nào sau đây?
A. O3. B. Cl2. C. H2S. D. O2.
Hướng dẫn giải:
Đáp án C.
Do phản ứng: H2S + H2SO4 → S + 2H2O + SO2
Bài 7: Cho FeS tác dụng với dung dịch H2SO4 loãng, thu được khí A; nếu dùng dung dịch H2SO4 đặc, nóng thì thu được khí B. Dẫn khí B vào dung dịch A thu được rắn C. Các chất A, B, C lần lượt là:
A. H2, H2S, S.
B. H2S, SO2, S.
C. H2, SO2, S.
D. O2, SO2, SO3.
Hướng dẫn giải:
Đáp án B.
FeS + H2SO4 → FeSO4 + H2S
2FeS + 10H2SO4 → Fe2(SO4)3 + 9SO2 + 10H2O
2H2S + SO2 → 3S + 2H2O
Bài 8: Cho 33,2g hỗn hợp X gồm Cu, Mg, Al tác dụng vừa đủ với dung dịch H2SO4 loãng thu được 22,4 lít khí ở đktc và chất rắn không tan B. Cho B hoà tan hoàn toàn vào dung dịch H2SO4 đặc, nóng dư thu được 4,48 lít khí SO2(đktc). Khối lượng mỗi kim loại trong hỗn hợp X lần lượt là:
A. 13,8; 7,6; 11,8
B. 11,8; 9,6; 11,8
C.12,8; 9,6; 10,8
D. kết quả khác
Hướng dẫn giải:
Đáp án C.
Kim loại không phản ứng với H2SO4 loãng là Cu.
Gọi nCu = x, nMg = y, nAl = z
Ta có 64x + 24y + 27z = 33,2 (1)
Bảo toàn e: 2nMg + 3nAl = 2
⇒ 2y + 3z = 2.1 (2)
⇒ x = 0,2 (mol) (3)
Từ 1, 2, 3 ⇒ x = 0,2; y = z = 0,4 (mol)
mCu = 0,2.64 = 12,8 (g); mMg = 0,4.24 = 9,6 (g); mAl = 10,8 (g)
Bài 9: Cho 11,2 g kim loại X tác dụng hết với H2SO4 đặc, nóng thu được 6,72 lít khí SO2 (đktc). Tên kim loại là:
A. đồng B. sắt C. kẽm D. nhôm
Hướng dẫn giải:
Đáp án B
Gọi hóa trị của kim loại là a.
nSO2 = 0,3 (mol)
Bảo toàn e nX.a = 2 nSO2
⇒ nX = 0,6/a
Mặt khác mX = 11,2 ⇒ MX = 56a/3
Với a = 3 MX = 56 (Fe)
Bài 10: Trường hợp nào sau đây không đúng?
A. SO2 vừa là chất oxi hóa, vừa là chất khử.
B. Phản ứng giữa H2S và SO2 dùng để thu hồi S trong các khí thải.
C. Ozon có tính khử mạnh và khử được Ag ở điều kiện thường.
D. Phản ứng giữa H2SO4 đặc với hợp chất hữu cơ gọi là sự than hoá.
Hướng dẫn giải:
Đáp án C.
Ozon oxi hóa Ag
2Ag + O3 → Ag2O + O2.
Bài 11: Trong sơ đồ:![]() . X là chất nào trong các chất dưới đây?
. X là chất nào trong các chất dưới đây?
A. SO2. B. H2S. C. H2S và SO2. D. S.
Hướng dẫn giải:
Đáp án A.
SO3 + H2O → H2SO4
2H2SO4 + Cu → CuSO4 + SO2 + 2H2O
SO2 + 2NaOH → Na2SO3 + H2O
Bài 12: Đốt cháy hoàn toàn 3,4 g một chất X thu được 6,4 g SO2 và 1,8 g H2O. X có công thức phân tử là
A. H2S B. H2SO4 C. H2SO3 D. H3SO4
Hướng dẫn giải:
Đáp án A.
Đốt cháy X thu đc SO2 vào H2O ⇒ Trong X có S,H và có thể có O
Trong 64 SO2 có 32g S
7.04______x g S
x=3,52g ⇒ nS = 0,11 (mol)
Trong 18g H2O có 2g H
1.98 y g H
y=0,22g ⇒ nH = 0,22(mol)
mO=3.74-3.52-0.22=0
Vậy trong X có H và S
Gọi CT X là HxSy
Ta có: x:y=0, 22: 0,11=2:1
⇒ CT X: H2S
Bài 13: Đốt 13 g bột một kim loại hóa trị II trong oxi dư đến khối lượng không đổi thu được chất rắn X có khối lượng 16,2 g (giải sử hiệu suất phản ứng là 100%). Kim loại đó là:
A. Cu B. Zn C. Fe D. Ca
Hướng dẫn giải:
Đáp án B.
Gọi kim loại là R.
Bảo toàn khối lượng mO = 16,2-13 = 3,2
⇒ nO2 = 0,1 (mol)
2R + O2 → 2RO
0,2 0,1
MR = 65(Zn)
Bài 14: Dãy gồm các chất chỉ có tính oxi hóa là:
A. H2O2, HCl, SO3.
B. O2, Cl2, S8.
C. O3, KClO4, H2SO4.
D. FeSO4, KMnO4, HBr.
Hướng dẫn giải:
Đáp án C
Bài 15: Chọn trường hợp sai:
A. H2SO4 đặc tác dụng với đường cho muội than.
B. Khí SO2 làm mất màu dung dịch Br2, dung dịch KMnO4.
C. Pha loãng axit H2SO4 đặc bằng cách cho từ từ nước vào axit đặc.
D. Khí H2S tác dụng với FeCl3 tạo bột màu vàng.
Hướng dẫn giải:
Đáp án C.
Cho từ từ axit vào nước.
Bài 16: Phát biểu nào sau đây không đúng?
A. SO2 có thể làm mất màu dung dịch brom.
B. H2S có mùi trứng thối.
C. SO3 tác dụng mạnh với nước và toả nhiệt.
D. H2S không phản ứng được với Cu(NO3)2.
Hướng dẫn giải:
Đáp án D.
H2S + Cu(NO3)2 → CuS + 2HNO3
Bài 17: Trong 5,6 gam bột sắt với 2,4 gam bột lưu huỳnh rồi nung nóng (trong điều kiện không có không khí), thu được hỗn hợp rắn M. Cho M tác dụng với lượng dư dung dịch HCl, giải phóng hỗn hợp khí X và còn lại một phần không tan G. Để đốt cháy hoàn toàn X và G cần vừa đủ V lít khí O2(đktc). Giá trị của V là
A. 2,80 B. 3,36 C. 3,08 D. 4,48
Hướng dẫn giải:
Đáp án A.
nFe = 0,1 (mol), nS=0,075 (mol)
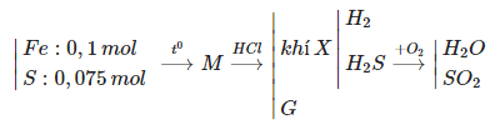
Fe ⟶ Fe2+ + 2e O2 + 4e → O2-
0,1 → 0,2 mol
S → S4+ + 4e
0,075 → 0,3 mol
Bảo toàn e: nFe.2 + nS.4 = nO2.4
⇒ nO2 = 0,125 (mol)
⟹ VO2 = 0,125.22,4 = 2,8 (lít).
Bài 18: Nung nóng hỗn hợp bột X gồm a mol Fe và b mol S trong khí trơ, hiệu suất phản ứng bằng 50%, thu được hỗn hợp rắn Y. Cho Y vào dung dịch HCl dư, sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Z có tỉ khối so với H2 bằng 5. Tỉ lệ a:b bằng
A. 2:1 B. 1:1 C. 3:1 D. 3:2
Hướng dẫn giải:
Đáp án A.
Fe + S → FeS
FeS + 2HCl → FeCl2 + H2S;
Fe + 2HCl → FeCl2 + H2
MZ = 5.2 = 10; Chọn 1 mol Z
⇒ nH2 + nH2S = 1
2nH2 + 34nH2S =10
⇒ nH2 =0,75 ; nH2S = 0,25
nFeS =nH2S = 0,25 mol; nFe (dư) = nH2S = 0,75 mol
⇒ nFe(bđ) = 0,25 + 0,75 = 1 (mol) ⇒ nS(bđ) = 0,25.100/50 = 0,5 (mol)
⇒ a : b = 1 : 0,5 = 2 : 1
Bài 19: Để phân biệt được 3 chất khí: CO2, SO2 và O2 đựng trong 3 bình mất nhãn riêng biệt, người ta dùng thuốc thử là
A. Nước vôi trong.
B. Dung dịch Br2.
C. Nước vôi trong và dung dịch Br2.
D. Dung dịch KMnO4.
Hướng dẫn giải:
Đáp án C.
Chất làm mất màu dung dịch brom là SO2.
SO2 + Br2 + 2H2O → 2HBr + H2SO4
Chất làm đục nước vôi trong là CO2
CO2 + Ca(OH)2 → CaCO3 + H2O
Còn lại là O2
Bài 20: Có thể dùng H2SO4 đặc để làm khô tất cả các khí trong dãy nào?
A. CO2, NH3, Cl2, N2.
B. CO2, H2S, N2, O2.
C. CO2, N2, SO2, O2.
D. CO2, H2S, O2, N2.
Hướng dẫn giải:
Đáp án C.
Nguyên tắc làm khô là H2SO4 đặc không phản ứng với chất được làm khô
Bài 21: Dẫn 8,96 lít (đktc) hỗn hợp khí X gồm H2S và CO2 vào lượng dư dung dịch Pb(NO3)2, thu được 23,9 gam kết tủa. Thành phần phần trăm thể tích của H2S trong X là
A. 25% B. 50% C. 60% D. 75%
Hướng dẫn giải:
Đáp án A
nX = 0,4 (mol)
n↓ = nPbS = 0,1 (mol)
Pb(NO3)2 + H2S → PbS + 2HNO3
Bài 22: Cho hỗn hợp khí oxi và ozon, sau một thời gian ozon bị phân hủy hết (2O3 3O2) thì thể tích khí tăng lên so với ban đầu là 2 lít. Thể tích của ozon trong hỗn hợp ban đầu là:
A. 4 lít O3 B. 3 lít O3 C. 2 lít O3 D. 6 lít O3
Hướng dẫn giải:
Đáp án A.
2 O3 → 3 O2
2lít O3 → 3lít O2 Vtăng = 1 lít
X lít O3 → Vtăng = 2 lít
⇒ X = 4
Bài 23: Hỗn hợp khí A gồm có O2 và O3,tỉ khối của hỗn hợp khí A đối với hiđro là 19,2. Hỗn hợp khí B gồm H2 và CO, tỉ khối của hỗn hợp khí B đối với hiđro là 3,6.Thành phần phần trăm theo thể tích của H2 và O2 lần lượt là?
A. 80%, 60% B. 20%, 40%
C.80%, 60% D. 20%, 60%
Hướng dẫn giải:
Đáp án A
Gọi số mol O2 trong 1 mol hỗn hợp A là x, thì số mol O3 trong hỗn hợp là (1 – x)
![]() ⇒ x = 0,6 (mol)
⇒ x = 0,6 (mol)
⇒ %VO2 = 60%,%VO3 = 40%.
- Gọi số mol H2 trong 1 mol hỗn hợp A là y, thì số mol CO trong hỗn hợp là (1 – y)
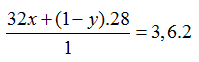
Giải được: y = 0,8 ⇒ %VH2 = 80%; Vco = 20%
Bài 24: Cho các cặp phản ứng sau:
(1) H2S + Cl2 + H2O →
(2) SO2 + H2S →
(3) SO2 + Br2 + H2O →
(4) S + H2SO4 đặc, nóng →
(5) S + F2 →
(6) SO2 + O2 →
Tổng số phản ứng tạo ra sản phẩm chứa lưu huỳnh ở mức oxi hóa +6 là:
A. 2. B. 3. C. 4. D. 5.
Hướng dẫn giải:
Đáp án C.
(1) H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
(3) SO2 + Br2 + 2H2O → 2HBr + H2SO4
(5) S + 3F2 → SF6
(6) 2SO2 + O2 → 2SO3
Bài 25: Dẫn 2,24 lít khí SO2 (đkc) vào 200 ml dung dịch KOH 1,5M vậy khi phản ứng xảy ra hoàn toàn thì thu được:
A. K2SO3 0,1M và KOH dư 0,4M
B. KHSO3 0,1M
C. K2SO3 0,5M và KOH dư 0,5M
D. KHSO3 0,1M và K2SO3 0,5M
Hướng dẫn giải:
Đáp án C.
nSO2 = 0,1 (mol); nKOH = 2.0,15 = 0,3 (mol)
nKOH/nSO2=0,3/0,1=3
Tạo K2SO3
SO2 + 2KOH → K2SO3 + H2O
0,1 0,2 0,1
nKOH dư = 0,1 mol ⇒ CKOH = 0,5M,
Bài 26: Hỗn hợp khí X gồm O2 và O3, tỉ khối hơi của X đối với H2 là 19,2. Đốt cháy hoàn toàn a mol khí CO cần 1 mol X. Giá trị của a là
A. 1,0 B. 2,0 C. 2,4 D. 2,6
Hướng dẫn giải:
Đáp án C.
MX = 19,2.2 = 38,4 ⇒
nO2 +nO3 =1 ;
32nO2 + 48nO3 = 38
⇒ nO2 =0,6 (mol) ;nO3 = 0,4 (mol)
CO + O → CO2 ⇒ nCO = a = 2nO2 + 3nO3 = 2.0,6 + 3.0,4 = 2,4 (mol)
Bài 27: Cho các cặp chất sau:
(1) Khí Cl2 và khí O2.
(2) Khí H2S và khí SO2.
(3) Khí H2S và dung dịch Pb(NO3)2.
(4) CuS và dung dịch HCl.
(5) Khí Cl2 và dung dịch NaOH.
Số cặp chất xảy ra phản ứng hoá học ở nhiệt độ thường là
A. 4. B. 3. C. 2. D. 1.
Hướng dẫn giải:
Đáp án B.
Các cặp 2,3,5
H2S + Pb(NO3)2 → PbS + 2HNO3
2H2S + SO2 → 3S + 2H2O
Cl2 + 2NaOH → NaCl + NaClO + H2O
Bài 28: Tiến hành các thí nghiệm sau
(1) O3 tác dụng với dung dịch KI.
(2) axit HF tác dụng với SiO2.
(3) khí SO2 tác dụng với nước Cl2.
(4) KClO3 đun nóng, xúc tác MnO2.
(5) Cho H2S tác dụng với SO2.
Số thí nghiệm tạo ra đơn chất là
A. 3. B. 2. C. 4. D. 1.
Hướng dẫn giải:
Đáp án A.
Các thí nghiệm 1,4,5.
O3 + 2KI + H2O → 2KOH + I2 + O2
2KClO3 → 2KCl + 3O2
2H2S + SO2 → 3S + 2H2O
Bài 29: Cho 11 gam hỗn hợp bột sắt và bột nhôm tác dụng với bột lưu huỳnh trong điều kiện không có không khí) thấy có 12,8 gam lưu huỳnh tham gia phản ứng. Khối lượng sắt có trong 11 gam hỗn hợp đầu là
A. 5,6 gam. B. 11,2 gam. C. 2,8 gam. D. 8,4 gam.
Hướng dẫn giải:
Đáp án A.
nS = 0,4 (mol)
⇒ mhh = mFe + mAl
Bảo toàn electron: 2nFe+ 3nAl = 2nS
⇒ 56nFe + 27 nAl = 11 ; 2nFe + 3nAl = 2.0,4
⇒ nFe = 0,1, nAl = 0,2 ⇒ mFe = 0,1.56 = 5,6 (gam)
Bài 30: Cho hỗn hợp gồm Fe và FeS tác dụng với dung dịch HCl dư, thu được 2,464 lít hỗn hợp khí X(đktc). Cho hỗn hợp khí này qua dung dịch Pb(NO3)2 dư thu 23,9g kết tủa màu đen . thể tích các khí trong hỗn hợp khí X là:
A. 0,224lít và 2,24 lít
B. 0,124 lít và 1,24 lít
C. 0,224lít và 3,24 lít
D.Kết quả khác
Hướng dẫn giải:
Đáp án A
FeS + 2HCl → FeCl2 + H2S
Fe + 2HCl → FeCl2 + H2
Pb(NO3)2 + H2S → PbS + 2HNO3
nkhí = 0,11 (mol) ;nH2S = nPbS = 0,1 (mol)
⇒ nH2 = 0,11 – 0,1 = 0,01 (mol)
⇒ VH2S=2,24 (l) ,VH2=0,224 (lít)
Trên đây VnDoc đã giới thiệu tới các bạn lý thuyết Hóa học 10: Trắc nghiệm chương 6: Nhóm Oxi, Lưu huỳnh phần 7. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 10, Giải bài tập Hóa học lớp 10, Giải bài tập Vật Lí 10, Tài liệu học tập lớp 10 mà VnDoc tổng hợp và giới thiệu tới các bạn đọc.








