Trắc nghiệm chương 6: Nhóm Oxi, Lưu huỳnh phần 5
Chuyên đề Hóa học lớp 10: Trắc nghiệm chương 6: Nhóm Oxi, Lưu huỳnh phần 5 được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Bài tập trắc nghiệm chương 6
Bài 1: Nhiệt phân hoàn toàn 24,5 gam KClO3 sau phản ứng thấy thoát ra V lít khí oxi (đktc). Giá trị của V là:
A. 4,48 lít B. 6,72 lít C. 2,24 lít D. 3,36 lít
Hướng dẫn giải:
Đáp án B
nKClO3=0,2 mol
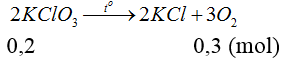
V = 0,3.22,4 = 6,72 lít
Bài 2: Hòa tan 12,8 gam hh Fe, FeO bằng dd HCl vừa đủ, thu được 2,24 lít (đktc). Thành phần phần trăm theo khối lượng của FeO trong hỗn hợp là:
A. 56,25% B. 43,75% C. 66,67% D. 33,33%
Hướng dẫn giải:
Đáp án A.
nH2=0,1 (mol) = nFe
mFe = 0,1.56 = 5,6 (g)
![]()
Bài 3: Trong sơ đồ chuyển hoá: S → FeS → H2S → H2SO4 → SO2 → S có ít nhất bao nhiêu phản ứng thuộc loại phản ứng oxi hoá-khử?
A. 3. B. 4. C. 2. D. 5.
Hướng dẫn giải:
Đáp án A
Ta có dãy chuyển đổi số OXH của S như sau:
![]()
Phản ứng thuộc loại phản ứng oxi hoá-khử khi S thay đổi số ôxi hóa. Nhưng H2SO4 → SO2 có thể là phản ứng: Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2 là phản ứng trao đổi
Bài 4: Phát biểu nào sau đây là sai?
A. SO2 được dùng làm chất chống nấm mốc.
B. NH3 được dùng để điều chế nguyên liệu cho tên lửa.
C. Dung dịch NaF được dùng làm thuốc chữa răng.
D. O3 là nguyên nhân chính gây nên biến đổi khí hậu toàn cầu.
Hướng dẫn giải:
Đáp án D
Ý "O3 là nguyên nhân chính gây nên biến đổi khí hậu toàn cầu." → sai, nguyên nhân chính là CO2
Bài 5: Người ta thu O2 bằng cách đẩy nước là do tính chất?
A. Khí oxi tan tốt nước
B. Khí oxi khó hoá lỏng.
C. Khí oxi ít tan trong nước.
D. Khí oxi nhẹ hơn nước.
Hướng dẫn giải: Đáp án C
Bài 6: Axit X là hóa chất quan trọng bậc nhất trong nhiều ngành sản xuất như phân bón, luyện kim,... ngoài ra trong phòng thí nghiệm, axit X còn dùng để hút ẩm. X là:
A. HCl. B. H2SiO3. C. H3PO4. D. H2SO4.
Hướng dẫn giải: Đáp án D
Bài 7: Dẫn 6,6 lít (đktc) hỗn hợp X gồm oxi và ozon qua dung dịch KI (dư) phản ứng hoàn toàn được 25,4 gam iot. Phần trăm thể tích oxi trong X là
A. 33,94%. B. 50%. C. 66,06%. D. 70%.
Hướng dẫn giải:
Đáp án C
O3 + 2KI + H2O → I2 + O2 + 2KOH (0,5đ)
0,1 0,1 (mol)
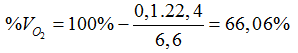
Sử dụng thông tin sau trả lời câu hỏi 103, 104. Cho 3,68 gam hỗn hợp gồm Al và Zn tác dụng với một lượng vừa đủ dung dịch H2SO4 10%, thu được 2,24 lít khí H2 (đktc).
Bài 8: Khối lượng muối thu được sau phản ứng là:
A. 13,28g B. 22,88 C. 10,98 D. 12,48gam
Đáp án A.
Bài 9: Khối lượng dung dịch thu được sau phản ứng là
A. 97,80 gam B. 101,48 gam C. 88,20 gam D. 101,68 gam
Đáp án B.
nH2 = 0,1 mol =nH2SO4
nmuối = mKL + mgốc axit = 3,68 + 0,1.96 = 13,28 (g)
mdd H2SO4 = 0,1.98.100/10 = 98 gam
mdd sau = 3,68 + 98 – (0,1.2) = 101,48 (gam)
Bài 10: Khi cho 7,68 gam Cu tác dụng với H2SO4 đặc, nóng, lấy dư. Thể tích khí SO2 thu được sau khi phản ứng xảy ra hoàn toàn ở (đktc) là:
A. 2,24 lít B. 2,688 lít C. 4,48 lít D. 6,72 lít
Đáp án B.
nCu = 0,12 (mol)
Bảo toàn e: 2nCu = 2
⇒ nSO2 = 0,12 (mol)
⇒ V = 0,12.22,4 = 2,688 (lít)
Bài 11: Thuốc thử duy nhất có thể dùng để phân biệt 3 dung dịch H2SO4 đặc, Ba(OH)2, HCl là:
A. Cu B. SO2 C. Quỳ tím D. O2
Hướng dẫn giải:
Đáp án C.
Chất làm quỳ tím đổi sang đỏ: H2SO4, HCl
Chất làm quỳ tím chuyển xanh là Ba(OH)2.Cho Ba(OH)2 vào hai dung dịch, chất tạo kết tủa trắng là H2SO4
Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
Bài 12: Hoà tan hoàn toàn 0,8125g kim loại R hoá trị II và dung dịch H2SO4 đặc nóng thu được 0,28 kít khí SO2 (đktc).Kim loại R là:
A. Mg B. Cu C. Zn D. Fe
Đáp án C.
Gọi hóa trị của kim loại là x.
nSO2 = 0,0125 (mol)
Bảo toàn e ta có: nR.x = 2nSO2
⇒ nR = 0,025/x
⇒ MR = 0,8125.x/0,025 ⇒ M = 32,5x
⇒ X = 2 ⇒ M = 65 (Zn)
Bài 13: Hấp thụ hoàn toàn 12 gam lưu huỳnh trioxit vào 100 gam nước. Nồng độ phần trăm của dung dịch thu được là (S = 32, O = 16, H = 1)
A. 12,00% B. 10,71% C. 13,13% D. 14,7%
Hướng dẫn giải:
Đáp án C
nSO3 = 0,15 (mol)
SO3 + H2O → H2SO4
0,15 0,15 (Mol)
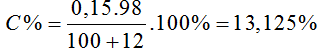
Bài 14: Để điều chế CuSO4, cho
A. CuO tác dụng với H2SO4 loãng
B. Cu tác dụng với axit loãng
C. CuCl2 tác dụng với axit loãng
D. A, C đúng
Hướng dẫn giải:
Đáp án A.
CuO + H2SO4 → CuSO4 + H2O
Bài 15: Oxi hoá 89,6 lít SO2(đktc) có xt thu được 240 gam SO3.Tính hiệu suất?
A.50% B.75% C.80%. D.Kết quả khác
Đáp án B
2SO2 + O2 → 2SO3
nSO2=4 mol, nSO3= 3 mol
⇒ H%=3/4=75%
Bài 16: Cho dd CuSO4 tác dụng với khí H2S(lấy dư) thu được 9,6 g kết tủa. Tính thể tích H2S cần dùng(đktc)
A.2,24 B.6,72 C.3,36 D. kết quả khác
Đáp án A.
CuSO4 + H2S → CuS + H2S
nCuS = 0,1 (mol)
V = 0,1.22,4 = 2,24 (lít)
Bài 17: Ở nhiệt độ thường
A. O2 không oxi hóa được Ag, O3 oxi hóa được Ag.
B. O2 oxi hóa được Ag, O3 không oxi hóa được Ag.
C. cả O2 và O3 đều không oxi hóa được Ag.
D. cả O2 và O3 đều oxi hóa được Ag.
Đáp án A
Bài 18: Cặp chất nào sau đây không tác dụng được với nhau?
A. Ag và O3
B. CO và O2
C. Mg và O2
D. CO2 và O2
Hướng dẫn giải:
Đáp án D
Ag + O3 → Ag2O + O2
2CO + O2 → 2CO2
2Mg + O2 → 2MgO
Bài 19: Hơi thủy ngân rất dộc, bởi vậy khi làm vỡ nhiệt kế thủy ngân thì chất bột được dùng để rắc lên thủy ngân rồi gom lại là
A. vôi sống. B. cát. C. muối ăn. D. lưu huỳnh.
Hướng dẫn giải:
Đáp án D
Hg+ S → HgS
Bài 20: Trộn sắt bột và lưu huỳnh bột rồi cho vào ống nghiệm khô. Đun ống nghiệm trên ngọn lửa đèn cồn, một lúc sau hỗn hợp cháy đỏ. Sản phẩm tạo thành là
A. sắt(II) sunfua có màu nâu đỏ.
B. sắt(II) sunfua có màu xám đen.
C. sắt(III) sunfua có màu nâu đỏ.
D. sắt(III) sunfua có màu xám đen.
Hướng dẫn giải: Đáp án B
Bài 21: Một mẫu khí thải (H2S, NO2, SO2, CO2) được sục vào dung dịch CuSO4, thấy xuất hiện kết tủa màu đen. Hiện tượng này do chất nào có trong khí thải gây ra?
A. H2S B. NO2 C. SO2 D. CO2
Hướng dẫn giải:
Đáp án A
CuSO4 + H2S → CuS + H2SO4
Bài 22: Thuốc thử nào sau đây dùng để phân biệt khí H2S với khí CO2?
A. dung dịch HCl
B. dung dịch Pb(NO3)2
C. dung dịch K2SO4
D. dung dịch NaCl
Hướng dẫn giải:
Đáp án B
Pb(NO3)2 + H2S → 2HNO3 + PbS
Bài 23: 1 mẫu khí thải công nghiệp có nhiễm các khí CO; CO2; H2S. Để nhận biết H2S ta dùng dung dịch:
A. Pb(CH3COO)2. B. FeSO4.
C. NaNO3. D. Ca(OH)2.
Hướng dẫn giải:
Đáp án A
H2S có phản ứng với Pb2+ tạo PbS kết tủa đen khác với CO và CO2 không xảy ra phản ứng.
Bài 24: Những phản ứng nào sau đây chứng minh tính oxi hóa của ozon mạnh hơn oxi
(1) O3 + Ag ![]()
(2) O3 + KI + H2O
(3) O3 + Fe ![]()
(4) O3 + CH4 ![]()
A. 1, 2. B. 2, 3. C. 2, 4. D. 3, 4.
Hướng dẫn giải:
Đáp án A.
O3 + 2Ag![]() Ag2O + O2
Ag2O + O2
O3 + 2KI + H2O → I2 + 2KOH + 2O2
Bài 25: Tính chất hóa học đặc trưng của nguyên tố oxi là
A. tính oxi hóa mạnh.
B. tính khử mạnh.
C. tính oxi hóa yếu.
D. vừa có tính oxi hóa, vừa có tính khử.
Hướng dẫn giải: Đáp án A.
Bài 26: Oxi hóa hoàn toàn 10,8 gam kim loại X trong khí O2 (dư), thu được 20,4 gam oxit kim loại. X là kim loại
A. Al B. Fe C. Mg D. Ca
Hướng dẫn giải:
Đáp án A.
Bảo toàn khối lượng: nO2 = (20,4-10,8)/32 = 0,3 mol
Bảo toàn electron: 10,8/M.n = 4.0,3 ⇒ M=9n ⇒ n=3; M=27(Al).
Bài 27: Phát biểu nào sau đây sai?
A. Ở nhiệt độ thường, H2S là chất khí không màu, có mùi trứng thối, rất độc.
B. Ở nhiệt độ thường, SO2 là chất khí không màu, mùi hắc, tan nhiều trong nước.
C. Ở nhiệt độ thường, SO3 là chất khí không màu, tan vô hạn trong nước.
D. Trong công nghiệp, SO3 được sản xuất bằng cách oxi hóa lưu huỳnh SO2.
Hướng dẫn giải:
Đáp án C
SO3 là chất lỏng.
Bài 28: Phát biểu nào sau đây sai?
A. H2S tan trong nước tạo thành dung dịch axit mạnh, có tính khử mạnh.
B. SO2 là chất vừa có tính oxi hóa, vừa có tính khử.
C. Ở nhiệt độ thường, SO3 là chất lỏng không màu, tan vô hạn trong nước.
D. Trong công nghiệp, SO2 đực sản xuất bằng cách đốt S hoặc FeS
Hướng dẫn giải:
Đáp án A.
H2S là dung dịch có tính axit yếu
Bài 29: Để diệt chuột trong một nhà kho người ta dùng phương pháp đốt lưu huỳnh, đóng kín cửa nhà kho lại. Chuột hít phải khói sẽ bị sưng yết hầu, co giật, tê liệt cơ quan hô hấp dẫn đến bị ngạt mà chết. Chất nào sau đây là nguyên nhân chính gây ra các hiện tượng trên?
A. H2S. B. SO2. C. SO3. D. H2SO4
Hướng dẫn giải: Đáp án B.
Bài 30: Sông Tô Lịch của Hà Nội đã từng đi vào ca dao:
“Nước sông Tô vừa trong vừa mát…”
Nhưng ngày nay, vào những năm đầu của thế kỉ 21, nước sông Tô Lịch bị ô nhiễm nghiêm trọng. Nước sông có màu đen. Những ngày nắng nóng, mùi hôi thối bốc lên làm cho các cư dân hai bên bờ sông và bất cứ ai đi ngang qua rất khó chịu. Nguyên nhân nào đã làm ô nhiễm nghiêm trọng dòng sông, một thời đã từng là niềm tự hào của người Hà Nội?
(a) Các nhà máy xả nước thải ra sông, chưa qua xử lí.
(b) Nước thải sinh hoạt của các khu dân cư, chưa qua xử lí.
(c) Việc thực hiện luật bảo vệ môi trường ở Việt Nam chưa nghiêm.
(d) Ý thức bảo vệ môi trường của người dân chưa cao.
Số phát biểu đúng là A. 1. B. 3. C. 2. D. 4.
Hướng dẫn giải: Đáp án D.
Trên đây VnDoc đã giới thiệu tới các bạn lý thuyết Hóa học 10: Trắc nghiệm chương 6: Nhóm Oxi, Lưu huỳnh phần 5. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 10, Giải bài tập Hóa học lớp 10, Giải bài tập Vật Lí 10, Tài liệu học tập lớp 10 mà VnDoc tổng hợp và giới thiệu tới các bạn đọc.








