Hóa 10 Bài 13: Liên kết cộng hóa trị
Hóa 10 Bài 13: Liên kết cộng hóa trị được VnDoc biên soạn, nội dung tóm tắt trọng tâm lý thuyết bài liên kết cộng hóa trị, giúp các bạn học sinh nắm chắc kiến thức từ đó vận dụng giải các bài tập sách giáo khoa, sách bài tập, học tập tốt hơn môn Hóa học 10. Mời các bạn tham khảo chi tiết nội dung dưới đây.
Liên kết cộng hóa trị
Tài liệu không những giúp các bạn học sinh có thể nắm chắc kiến thức nội dung bài học hóa 10 bài 13, còn giúp quý thầy cô có thêm tài liệu biên soạn phục vụ công tác giảng dạy.
A. Tóm tắt lý thuyết hóa 10 bài 13
1. Liên kết cộng hóa trị hình thành giữa các nguyên tử giống nhau. Sự hình thành đơn chất.
Định nghĩa: Là liên kết được hình thành giữa 2 nguyên tử bằng một hay nhiều cặp electron dùng chung.
a) Sự hình thành phân tử H2
H• + •H → H : H → H - H → H2
Mỗi nguyên tử hiđro có 1 e; 2 nguyên tử hiđro liên kết với nhau bằng cách mỗi nguyên tử góp 1e tạo thành 1 cặp e chung trong phân tử H2.
Quy ước
Mỗi châm (-) bên kí hiệu nguyên tố biểu diễn 1 electron ở lớp ngoài cùng.
Kí hiệu H : H được gọi là công thức electron, thay 2 chấm (:) bằng 1 (-) ta có H-H được công thức cấu tạo
Giữa 2 nguyên tử H có 1 cặp electron chung, liên kết biểu thị bằng (-), đó là liên kết đơn.
b) Sự hình thành phân tử N2
Trong phân tử N2, mỗi nguyên tử Nito đạt được cấu hình 8 electron giống khí hiếm Ar bằng cách mỗi nguyên tử góp 3 electron tạo thành electron chung
N (Z= 7): 1s22s22p3
:N:. + .: N: → :N:::N: → N ≡ N
CT e CTCT
Hai nguyên tử N liên kết với nhau bằng 3 cặp electron liên kết biểu thị bằng 3 gạch (≡ ) => hình thành liên kết 3
Các phân tử H2, O2, N2, Cl2.. tạo nên từ hai nguyên tử của cùng một nguyên tố (có độ âm điện như nhau) nên cặp electron chung không bị lệch về phía nguyên tử nào.
c) Khái niệm liên kết cộng hóa trị
Định nghĩa: Liên kết cộng hóa trị là liên kết được tạo nên từ 2 nguyên tửu bằng 1 hay nhiều cặp electron chung.
Mỗi cặp electron chung tạo nên 1 liên kết cộng hóa trị, nên ta có liên kết đơn (trong phân tử H2) và liên kết ba (trong phân tử N2)
Liên kết trong các phân tử H2 và N2 tạo nên từ 2 nguyên tử của cùng 1 nguyên tố (có độ âm điện như nhau), do đó cặp e dung chung không bị lệch về phía nguyên tử nào, gọi là liên kết cộng hóa trị không phân cực.
2. Liên kết giữa các nguyên tử khác nhau. Sự hình thành hợp chất.
a) Sự hình thành phân tử HCl
Trong phân tử hiđro, mỗi nguyển tử (H và Cl) góp 1 electron tạo thành một cặp electron chung để tạo liên kết cộng hóa trị. Cặp electron liên kết bị lệch về phía Clo, (Độ âm điện của Cl là 3,5 lớn hơn độ âm điện của H là 2,1) liên kết cộng hóa trị này bị phân cực.
Công thức electron: ![]()
Công thức cấu tạo: H – Cl
Đây là liên kết cộng hóa trị phân cực
b) Sự hình thành phân tử khí cacbonic CO2 (Có cấu tạo thẳng)
Hóa trị của một nguyên tố trong hợp chất cộng hóa trị gọi là cộng hóa trị và bằng số liên kết mà nguyên tử nguyên tố đó tạo ra được với các nguyên tử khác trong phân tử.
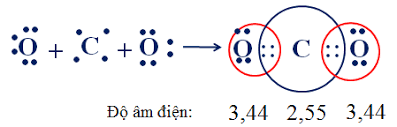
Công thức cấu tạo: O = C = O
Theo công thức electron, mỗi nguyên tử C hay O đều có 8e ở lớp ngoài cùng đạt cấu hình của khí hiếm nên phân tử CO2 bền vững.
c) Dấu hiệu nhận biết liên kết cộng hóa trị có trong phân tử
Phân tử đơn chất và hợp chất được hình thành từ phi kim.
VD: O2, F2, H2, N2, F2O, HF, H2O,….
3. Hiệu độ âm điện và liên kết hóa học
Hiệu số độ âm điện: Δx
Từ 0,0 ≤ Δx < 0,4 thì liên kết được gọi là liên kết cộng hóa trị không cực.
Nếu 0,4 ≤ Δx < 1,7 thì liên kết được gọi là liên kết cộng hóa trị có cực.
Nếu Δx ≥ 1,7 liên kết ion
Ví dụ: Trong NaCl có hiệu độ âm điện Δx = độ âm điện của Na - độ âm điện của Cl = 3,16 - 0,93 = 2,23 => Vậy liên kết giữa Na với Cl là liên kết ion
So sánh liên kết cộng hóa trị không cực, cộng hóa trị có cực và liên kết ion
Giống nhau: Các nguyên tử kết hợp với nhau tạo ra mỗi nguyên tử lớp electron ngoài cùng bền vững giống cấu trúc của khí hiếm (quy tắc bát tử)
Khác nhau
| Cộng hóa trị không cực | Cộng hóa trị có cực | Liên kết ion | |
| Sự hình thành liên kết | Cặp electron ở giữa 2 nguyên tử | Cặp electron chung lệch về nguyên tử có độ âm điện lớn hơn | Nguyên tử kim loại nhường electron, nguyên tử phi kim nhận electron |
| Điều kiện liên kết | Giữa 2 phi kim giống hệt nhau | Giữa 2 phi kim mạnh yếu khác nhau | Giũa kim loại điển hình và phi kim điển hình. |
>> Mời các bạn tham khảo thêm lý thuyết hóa 10 bài 13 tại: Hóa 10 bài 15: Hóa trị và số oxi hóa
B. Giải Hóa 10 bài 13: Liên kết cộng hóa trị
Để giúp các bạn học sinh có thể hoàn thành tốt các dạng bài tập sách giáo khoa cũng như biết cách vận dụng kiến thức đã học của bài áp dụng vào các dạng bài tập, từ đó rèn luyện kĩ năng thao tác giải bài tập. VnDoc đã biên soạn hướng dẫn giải các bài tập sách giáo khoa hóa 10 bài 13 tại: Giải Hóa 10 bài 13: Liên kết cộng hóa trị
C. Giải SBT Hóa 10 bài 13
Ngoài các dạng bài tập sách giáo khoa cũng như bài tập sách bài tập, VnDoc đã biên soạn thêm bộ câu hỏi tự luận theo từng bài, hy vọng có thêm tài luyện ôn luyện củng cố kiến thức cho bạn. Mời các bạn tham khảo tài liệu giải sách bài tập Hóa 10 bài 13 tại: Giải SBT Hóa 10 bài 13
D. Trắc nghiệm hóa 10 bài 13: Liên kết cộng hóa trị
Câu 1: Liên kết cộng hóa trị được tạo thành bằng
A. sự chuyển hẳn electron từ nguyên tử này sang nguyên tử khác
B. sự góp chung cặp electron của hai nguyên tử.
C. cặp electron dung chung giữa hai nguyên tử, nhưng cặp electron này chỉ do một nguyên tử cung cấp.
D. sự tương tác giữa các nguyên tử và ion ở nút mạng tinh thể với dòng electron tự do.
Câu 2: Phân tử chất nào sau đây chỉ có các liên kết cộng hóa trị phân cực?
A. H2O
B. C2H6
C. N2
D. MgCl2
Câu 3: Phân tử chất nào sau đây ít phân cực nhất?
A. HCl
B. HF
C. HI
D. HBr
Câu 4: Liên kết trong phân tử chất nào sau đây mang nhiều tính chất cộng hóa trị nhất?
A. KCl
B. AlCl3
C. NaCl
D. MgCl2
Câu 5: Phân tử chất nào sau đây có liên kết cho – nhận?
A. H2O
B. NH3
C. H2O2
D. HNO3
Bộ câu hỏi trắc nghiệm gồm 12 câu hỏi nằm trong nội dung hóa 10 bài 13. Giúp củng cố kiến thức bài học, cũng như rèn luyện kĩ năng thao tác tính toán dành cho bạn đọc. Để tải xem toàn bộ câu hỏi và đáp án hướng dẫn giải chi tiết tại: Trắc nghiệm Hóa học 10 bài 13: Liên kết cộng hóa trị
.........................
>> Mời các bạn tham khảo thêm một số tài liệu liên quan
- Giải bài tập Hóa 10 Bài 14: Tinh thể nguyên tử và tinh thể phân tử
- Giải Hóa 10 Bài 15: Hóa trị và số oxi hóa
- Trắc nghiệm Hóa học 10 bài 15: Hóa trị và số oxi hóa
- Chất nào sau đây có liên kết cộng hóa trị không cực
Trên đây VnDoc đã giới thiệu Hóa 10 Bài 13: Liên kết cộng hóa trị tới các bạn. Để có kết quả học tập tốt và hiệu quả hơn, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Hóa học 10, Chuyên đề Vật Lý 10, Chuyên đề Hóa học 10, Giải bài tập Toán 10. Tài liệu học tập lớp 10 mà VnDoc tổng hợp biên soạn và đăng tải.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THPT miễn phí trên Facebook, mời bạn đọc tham gia nhóm Tài liệu học tập lớp 10 để có thể cập nhật thêm nhiều tài liệu mới nhất.









