Tóm tắt lý thuyết Hóa học 10 - Chương 3: Liên kết hóa học
Tóm tắt lý thuyết Hóa học lớp 10 chương 3: Liên kết hóa học là tài liệu hóa học hay, giúp các bạn học sinh hệ thống kiến thức hóa học vô cơ lớp 10 theo từng chuyên đề. Với tài liệu này, các bạn sẽ được củng cố kiến thức về liên kết cộng hóa trị, liên kết ion, liên kết kim loại... Mời các bạn cùng tham khảo.
>> Mời các bạn tham khảo một số tài liệu ôn tập học kì 1 hóa 10
- 17 bộ đề thi học kì 1 môn Hóa học lớp 10
- Bộ 3 đề thi học kì 1 môn Hóa học lớp 10 năm 2022 - 2023 Có đáp án
- Đề cương ôn tập hóa 10 học kì 1 năm 2022
Tóm tắt lý thuyết Hóa học 10 Chương 3: Liên kết hóa học
A. Tóm tắt lý thuyết hóa 10 chương 3
Các nguyên tử có xu hướng liên kết với nhau để đạt cấu hình electron bền vững của khí hiếm. Tuân theo qui tắc bát tử (8 điện tử).
Qui tắc bát tử: Các nguyên tử có khuynh hướng liên kết với nguyên tử khác để đạt cấu hình có 8 điện tử (hoặc 2 điện tử)
Tuy nhiên vẫn có một số trường hợp ngoại lệ như NO, PCl5, NO2...
1. Liên kết cộng hóa trị.
1.1. Định nghĩa: Là liên kết hoá học được hình thành do sự dùng chung các cặp e.
1.2. Ví dụ: H2, Cl2, HCl, CO2, HNO3...
1.3. Điều kiện: Các nguyên tử giống nhau hay gần giống nhau về bản chất (thường là những nguyên tố phi kim nhóm IVA, VA, VIA, VIIA)
1.4. Phân loại theo sự phân cực:
+ Liên kết cộng hóa trị không phân cực là liên kết cộng hóa trị mà trong đó cặp electron dùng chung không bị lệch về phía nguyên tử nào.
Ví dụ: Cl2, H2.
+ Liên kết cộng hóa trị có cực là liên kết cộng hóa trị mà cặp electron dùng chung bị lệch về phía nguyên tử có độ âm điện lớn hơn.
Ví dụ: HCl, H2O.
1.5. Hoá trị của các nguyên tố trong hợp chất chứa liên kết công hoá trị
a. Tên gọi: Cộng hoá trị
b. Cách xác định: Cộng hoá trị = số liên kết nguyên tử tạo thành
1.6. Tinh thể nguyên tử:
a. Khái niệm: Tinh thể được hình thành từ các nguyên tử
b. Lực liên kết: Liên kết với nhau bằng liên kết cộng hoá trị
c. Đặc tính: Nhiệt độ nóng chảy, nhiệt độ sôi cao.
d. Ví dụ: Tinh thể kim cương
1.7. Tinh thể phân tử:
a. Khái niệm: Tinh thể được hình thành từ các phân tử
b. Lực liên kết: Lực tương tác giữa các phân tử
c. Đặc tính: Ít bền, độ cứng nhỏ, nhiệt nóng chảy và nhiệt độ sôi thấp.
d. Ví dụ: Tinh thể nước đá, tinh thể iốt
2. Liên kết ion
2.1. Các định nghĩa.
a. Cation: Là ion mang điện tích dương
M → Mn+ + ne (M: kim loại, n = 1, 2, 3)
b. Anion: Là ion mang điện tích âm
X + ne → Xn- (X: phi kim, n = 1, 2, 3)
c. Liên kết ion: Là liên kết hoá học hình thành do lực hút tĩnh điện giữa các ion trái dấu.
2.2. Bản chất: Sự cho – nhận các e
2.3. Ví dụ: Xét phản ứng giữa Na và Cl2.
Phương trình hoá học:
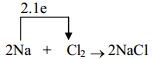
Sơ đồ hình thành liên kết:
![]() (viết theo dạng cấu hình e)
(viết theo dạng cấu hình e)
Liên kết hoá học hình thành do lực hút tĩnh điện giữa ion Na+ và ion Cl- gọi là liên kết ion, tạo thành hợp chất ion.
2.4. Điều kiện liên kết: Xảy ra ở các kim loại điển hình và phi kim điển hình.
2.5. Tinh thể ion:
- Được hình thành từ những ion mang điện trái dấu đó là cation và anion
- Lực liên kết: Có bản chất tĩnh điện
- Đặc tính: Bền, khó nóng chảy, khó bay hơi
- Ví dụ: Tinh thể muối ăn (NaCl)
2.6. Hoá trị của các nguyên tố trong hợp chất có liên kết ion
Tên gọi: Điện hoá trị
Cách xác định: Điện hoá trị = Điện tích của ion đó
3. Hiệu độ âm điện và liên kết hóa học
Xét chất AxBy, ![]()

Ví dụ : Dựa và độ âm điện của các chất hãy xác định loại liên kết hoá học tồn tại trong các hợp chất
sau : O2. CO2, HCl, NaCl, CH4, AlCl3...
4. Sự lai hóa các obitan
a. Khái niệm: Sự lai hoá obitan nguyên tử là sự tổ hợp (trộn lẫn) một số obitan trong nguyên tử để được các obitan lai hoá giống nhau nhưng định hướng khác nhau trong không gian.
* Số obitan lai hoá = Tổng số các obitan tham gia tổ hợp.
* Sự lai hoá được xét đối với các nguyên tử trung tâm.
b. Các kiểu lai hoá thường gặp
b1. Lai hoá sp (lai hoá đường thẳng): Sự tổ hợp 1AO(s) + 1AO(p) → 2AO(sp)
Phân tích: AO(s) hình cầu, AO(p) hình số 8 nổi , AO(sp) hình số 8 nổi không cân đối, hai AO lai hoá tạo với nhau một góc 180o (đường thẳng)
Ví dụ: Xét trong phân tử BeH2, C2H2, BeCl2
b2. Lai hoá sp2 (lai hoá tam giác): Sự tổ hợp 1AO(s) + 2AO(p) → 3AO(sp2)
Phân tích: AO(s) hình cầu, AO(p) hình số 8 nổi , AO(sp2) hình số 8 nổi không cân đối, ba AO lai hoá tạo với nhau một góc 120o
Ví dụ: Xét trong phân tử BeF3 , C2H4, BCl3...
b3. Lai hoá sp3 (lai hoá tứ diện ): Sự tổ hợp 1AO(s) + 3AO(p) → 4AO(sp3)
Phân tích: AO(s) hình cầu, AO(p) hình số 8 nổi , AO(sp3) hình số 8 nổi không cân đối,
bốn AO lai hoá tạo với nhau một góc 109o28'
Ví dụ: Thường gặp ở các nguyên tử O, C, N
Xét trong phân tử CH4, H2O, NH3...
c. Áp dụng: Giải thích sự lai hoá của các nguyên tử trung tâm trong các hợp chất sau đây: C2H2, BCl3, H2O.
5. Sự xen phủ các obitan
a. Xen phủ trục: Trục của các AO tham gia liên kết trùng với đường nối tâm của 2 nguyên
tử được gọi là sự xen phủ trục.
Sự xen phủ trục tạo thành liên kết (xích ma) bền, khó bị cắt đứt, các hợp chất có chứa
liên kết thường có hứớng ưu tiên " dễ thế hơn cộng "
Gồm các loại xen phủ: s – s , s – p , p – p
b. Xen phủ bên: Trục của các AO tham gia liên kết song song với nhau và vuông góc với
đường nối tâm của 2 nguyên tử được gọi là sự xen phủ bên.
Sự xen phủ bên tạo thành liên kết (pi) kém bền, linh động, các hợp chất có chứa liên kết
thường có hướng ưu tiên " dễ cộng hơn thế ". Gồm các loại xen phủ: p – p
c. Sự tạo thành liên kết đơn, đôi, ba.
+ Liên kết đơn: Liên kết cộng hoá trị do dùng chung một cặp e, được viết là " __ ", các liên
kết đơn đều là liên kết bền vững.
+ Liên kết đôi: Liên kết cộng hoá trị do dùng chung hai cặp e, được viết là " = ", các liên
kết đôi được tạo thành từ 1 + 1
+ Liên kết ba: Liên kết cộng hoá trị do dùng chung ba cặp e, được viết '' = ", được tạo bởi
1 + 1
+ Xét về độ bền liên kết thì liên kết ba > liên kết đôi > liên kết đơn
+ Liên kết đôi hay ba còn được gọi là liên kết bội.
6. Hóa trị
Hóa trị: là biểu thị khả năng nguyên tử nguyên tố này liên kết với một số nhất định nguyên
tử nguyên tố khác.
a. Điện hóa trị:
Là hóa trị của một nguyên tố trong hợp chất ion, tính bằng điện tích của ion đó.
Ví dụ: CaCl2 là hợp chất ion, hóa trị Canxi là 2+ , Clo là 1-
b. Cộng hóa trị:
Là hóa trị của một nguyên tố trong hợp chất cộng hóa trị, tính bằng số liên kết mà nguyên tử
của nguyên tố đó có thể tạo thành với nguyên tử của nguyên tố khác.
Ví dụ: CH4 là hợp chất cộng hóa trị, hóa trị của Cacbon là 4, Hidrô là 1.
c. Áp dụng:
Xác định hoá trị của các nguyên tố trong các hợp chất sau
NaCl, NH3, N2O5, CaSO4, HNO3, (NH4)2SO4...
7. Số oxi hóa
a. Khái niệm: là điện tích của nguyên tử (điện tích hình thức) trong phân tử nếu giả định rằng các cặp electron chung coi như chuyển hẳn về phía nguyên tử có độ âm điện lớn hơn.
b. Cách xác định số oxi hoá.
Qui ước 1: Số oxi hoá của nguyên tố trong đơn chất bằng không
Fe0 Al0 H0 O20 Cl20
Qui ước 2 : Trong một phân tử tổng số oxi hoá của các nguyên tố bằng không.
H2SO4 2(+1) + x + 4(-2) = 0 x = +6
K2Cr2O7 2(+1) + 2x + 7(-2) = 0 x = +6
Qui ước 3: Số oxihoá của các ion đơn nguyên tử bằng điện tích của ion đó.Trong ion đa nguyên tử tổng số oxihoá của các nguyên tố bằng điện tích của ion đó.
Qui ước 4: Trong hầu hết các hợp chất, số oxi hoá của hiđrô bằng +1 ( trừ hiđrua của kim loại NaH, CaH2...). Số oxihóa của oxi bằng -2 (trừ trường hợp OF2 và peoxit H2O2...)
c. Cách ghi số oxi hoá .
Số oxi hoá đặt phía trên kí hiệu nguyên tố, dấu ghi trước số ghi sau.
Ví dụ: Xác định số oxihoá của các nguyên tố N, S, P trong các chất sau:
a. NH3, N2, NO, N2O, N2O3, N2O4, N2O5, HNO3, NH4NO3, NaNO3, Ca3N2
b. H2S, FeS, FeS2, SO2, SO3, NaHSO3, H2SO4
c. PH3, Zn3P2, PCl3, PCl5, H3PO4, H3PO3, Ca3(PO4)2
d. ion NO3-, SO32-, SO42-, PO32-, PO43-
8. Liên kết kim loại
a. Khái niệm: là liên kết được hình thành giữa các nguyên tử và ion kim loại trong mạng tinh thể do sự tham gia của các e tự do.
b. Điều kiện liên kết: Xảy ra ở hầu hết các kim loại.
c. Mạng tinh thể kim loại
+ Lập phương tâm khối: Nguyên tử kim loại, ion kim loại nằm ở tâm và các đỉnh của khối lập phương.
Ví dụ: Li, Na, K, Rb, V, Cr, Fe, Nb, Mo, Ta, W, Eu
+ Lập phương tâm diện: Nguyên tử kim loại, ion kim loại nằm ở tâm các mặt và các đỉnh của khối lập phương.
Ví dụ: Ca, Sr, Al, Ni, Cu, Ag, Au...
+ Lục phương: Nguyên tử kim loại, ion kim loại nằm ở tâm các mặt của hình lục giác đứng và các đỉnh của hình lục giác.
Ví dụ : Be, Mg, Zn, Cd, Co, La...
d. Tính chất của tinh thể kim loại:
Mạng tinh thể kim loại có các e tự do di chuyển được trong mạng tinh thể nên kim loại có một số tính chất cơ bản: Ánh kim, dẫn điện tốt, dẫn nhiệt tốt và có tính dẻo
B. Câu hỏi trắc nghiệm hóa 10 chương 3
Câu 0. Chất nào sau đây có liên kết cộng hóa trị không cực
A. N2, Cl2, HCl, H2, F2.
B. N2, Cl2, HI, H2, F2.
C. N2, Cl2, H2O, H2, F2.
D. N2, Cl2, I2, H2, F2.
Câu 1. Chất nào sau đây có liên kết cộng hóa trị không cực?
A. H2S
B. Al2S3
C. O2
D. SO2
Câu 2. Chất nào sau đây có liên kết cộng hóa trị có cực?
A. Cl2
B. NH3
C. NaCl
D. O2
Câu 3. Phân tử chất nào sau đây chỉ có liên kết cộng hóa trị
A. NH4Cl
B. H2O
C. NaCl
D. Ca(NO3)2
Câu 4. Trong phân tử của hợp chất nào sau đây có liên kết ion?
A. NH4Cl
B. NH3
C. CaO
D. H2O
Câu 5. Trong phân tử HF, HCl, HBr, HI đều có chung 1 dạng liên kết đó là:
A. Liên kết ion B. Liên kết cộng hóa trị có cực
C. Liên kết cộng hóa trị không cực D. Liên kết đôi
Câu 6. Định nghĩa nào sau đây đúng với liên kết cộng hóa trị?
A. Là liên kết giữa hai nguyên tử cộng chung mỗi nguyên tử một đôi electron
B. Là liên kết giữa hai ion
C. Là liên kết giữa hai phân tử mang điện tích trái dấu
D. Là liên kết giữa hai tử dùng chung đôi điện tử chưa tham gia liên kết
Câu 7. Hãy cho biết những phân tử nào sau đây có phân cực trong liên kết?
A. O2, N2, H2
B. HBr, NH3, HCl
C. F2, HF, Cl2
D. I2, Br2, HI
Câu 8. Hoàn thành nội dung sau: "Trong hợp chất cộng hóa trị, hóa trị của một nguyên tố được xác định bằng ....... của nguyên tử nguyên tố đó trong phân tử''
A. Số electron hóa trị
B. Số electron độc thân
C. Số electron tham gia liên kết
D. Số obitan hóa trị
Câu 9: Chọn phát biểu đúng nhất: liên kết cộng hóa trị là liên kết :
A. giữa các phi kim với nhau.
B. trong đó cặp electron chung bị lệch về một nguyên tử.
C. được hình thành do sự dùng chung electron của hai nguyên tử khác nhau.
D. được hình thành giữa hai nguyên tử bằng các cặp electron chung
Câu 10: Chỉ ra phát biểu sai về phân tử CO2:
A. Phân tử có cấu tạo góc.
B. Liên kết giữa nguyên tử O và C là phân cực.
C. Phân tử CO2 không phân cực.
D. Trong phân tử có hai liên kết đôi.
Để xem đầy đủ nội dung tài liệu ấn link TẢI VỀ phía dưới











