Hóa học 10 Bài 5: Cấu hình electron nguyên tử
Hóa học 10 Bài 5: Cấu hình electron nguyên tử được VnDoc biên soạn là nội dung bài cấu hình electron nằm trong chương trình Hóa học 10. Nội dung tài liệu đi sâu vào các phần, giúp các bạn học nắm chắc kiến thức bài học. Từ đó vận dụng làm các dạng bài tập sách giáo khoa và sách bài tập.
Cấu hình Electron
Hy vọng qua Hóa học 10 bài 5 này giúp các bạn học sinh nắm chắc kiến thức bài học cũng như giúp quý thầy cô trong quá trình soạn hóa 10 bài 5 của mình. Mời các bạn tham khảo.
A. Tóm tắt lý thuyết Hóa 10 bài 5
I. Thứ tự các mức năng lượng trong nguyên tử
1. Nguyên lí vững bền
Các electron nguyên tử ở trạng thái cơ bản lần lượt chiếm các mức năng lượng từ thấp đến cao.
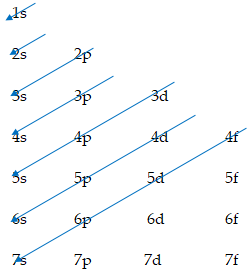
- Thứ tự sắp xếp mức năng lượng (phân mức năng lượng) theo chiều mũi tên:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s …
- Thứ tự các lớp electron: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 4f…
2. Nguyên lí Pauli
Trên 1 obitan nguyên tử chứa tối đa 2 electron và có chiều tự quay khác chiều nhau xung quanh trục riêng của mỗi electron.
3. Quy tắc Hund
Trong cùng 1 phần lớp, các electron điền vào các obitan sao cho electron độc thân là lớn nhất.
Ví dụ: Có 5e phân bố trong 3AO của phân lớp p như sau:
![]()
II. Cấu hình electron nguyên tử
1. Cấu hình electron của nguyên tử
Cấu hình electron của nguyên tử biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.
- Người ta quy ước cách viết cấu hình electron nguyên tử như sau:
+ Số thứ tự lớp electron được ghi bằng chữ số (1, 2, 3,…)
+ Phân lớp được ghi bằng các chữ cái thường (s, p, d, f,…)
+ Số electron trong một phân lớp được ghi bằng số ở phía trên bên phải phân lớp (s2, p6,…).
- Cách viết cấu hình electron nguyên tử gồm các bước sau:
Bước 1: Xác định số electron của nguyên tử
Bước 2: Các electron được phân bố lần lượt vào các phân lớp theo chiều tăng của năng lượng trong nguyên tử (1s 2s 2p 3s 3p 3p 4s 3d 4p 5s…) và tuân theo quy tắc sau: phân lớp s chứa tối đa 2 electron; phân lớp p chứa tối đa 6 electron; phân lớp d chứa tối đa 10 electron; phân lớp f chứa tối đa 14 electron.
Bước 3: Viết cấu hình electron biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau (1s 2s 3s 3p 3d 4s 4p....)
Ví dụ: Viết cấu hình electron nguyên tử của các nguyên tố sau:
+ H (Z = 1): 1s1
+ Ne (Z = 10): 1s22s22p6
+ Fe (Z = 26): 1s22s22p63s23p64s23d6
- Cách xác định nguyên tố s, p, d, f
+ Nguyên tố s: là những nguyên tố mà nguyên tử có electron cuối cùng điền vào phân lớp s
+ Nguyên tố p:là những nguyên tố mà nguyên tử có electron cuối cùng điền vào phân lớp p.
+ Nguyên tố d: là những nguyên tố mà nguyên tử có electron cuối cùng điền vào phân lớp d.
+ Nguyên tố f:là những nguyên tố mà nguyên tử có electron cuối cùng điền vào phân lớp f.
2. Cấu hình electron nguyên tử của 20 nguyên tố đầu.
| Z | Tên nguyên tố | Kí hiệu hóa học | Số electron | Cấu hình electron của nguyên tử | |||
| Lớp K (n =1) |
Lớp L (n =2) |
Lớp M (n=3) |
Lớp N (n= 4) | ||||
| 1 | Hiđro | H | 1 | 1s1 | |||
| 2 | Heli | He | 2 | 1s2 | |||
| 3 | Liti | Li | 2 | 1 | 1s22s1 | ||
| 4 | Beri | Be | 2 | 2 | 1s22s2 | ||
| 5 | Bo | B | 2 | 3 | 1s22s22p1 | ||
| 6 | Cacbon | C | 2 | 4 | 1s22s22p2 | ||
| 7 | Nito | N | 2 | 5 | 1s22s22p3 | ||
| 8 | Oxi | O | 2 | 6 | 1s22s22p4 | ||
| 9 | Flo | F | 2 | 7 | 1s22s22p5 | ||
| 10 | Neon | Ne | 2 | 8 | 1s22s22p6 | ||
| 11 | Natri | Na | 2 | 8 | 1 | 1s22s22p63s1 | |
| 12 | Magie | Mg | 2 | 8 | 2 | 1s22s22p63s2 | |
| 13 | Nhôm | Al | 2 | 8 | 3 | 1s22s22p63s23p1 | |
| 14 | Silic | Si | 2 | 8 | 4 | 1s22s22p63s23p2 | |
| 15 | photpho | P | 2 | 8 | 5 | 1s22s22p63s23p3 | |
| 16 | Lưu huỳnh | S | 2 | 8 | 6 | 1s22s22p63s23p4 | |
| 17 | Clo | Cl | 2 | 8 | 7 | 1s22s22p63s23p5 | |
| 18 | Agon | Ar | 2 | 8 | 8 | 1s22s22p63s23p6 | |
| 19 | Kali | K | 2 | 8 | 8 | 1 | 1s22s22p63s23p64s1 |
| 20 | Canxi | Ca | 2 | 8 | 8 | 2 | 1s22s22p63s23p64s2 |
3. Đặc điểm của lớp electron ngoài cùng
- Đối với tất cả các nguyên tố, lớp ngoài cùng có nhiều nhất là 8 electron (không tham gia vào các phản ứng hóa học)
- Khí hiếm (trừ He có 2e lớp ngoài cùng) có 8e lớp ngoài cùng
- Kim loại: 1, 2, 3 e lớp ngoài cùng
- Phi kim: 5, 6, 7 e lớp ngoài cùng
- Nguyên tử có 4 electron ngoài cùng có thể là nguyên tử của nguyên tố kim loại hoặc phi kim.
B. Giải bài tập hóa 10 bài 5 SGK
Để giúp các bạn học hoàn thành tốt các câu hỏi bài tập cuối bài trong sách giáo khoa, VnDoc đã biên soạn hướng dẫn các bạn học sinh làm các bài tập tại: Giải bài tập trang 27, 28 SGK Hóa học lớp 10: Cấu hình electron của nguyên tử
C. Trắc nghiệm hóa học 10 bài 5: Cấu hình electron nguyên tử
Nhằm củng cố, nâng cao các dạng bài tập cho các bạn học sinh sau bài học, VnDoc biên soạn bộ câu hỏi trắc nghiệm tại: Trắc nghiệm Hóa học 10 bài 5: Cấu hình electron nguyên tử
...............................................
Trên đây VnDoc đã giới thiệu Hóa học 10 Bài 5: Cấu hình electron nguyên tử tới các bạn. Để có kết quả học tập tốt và hiệu quả hơn, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Hóa học 10, Chuyên đề Vật Lý 10, Chuyên đề Hóa học 10, Giải bài tập Toán 10. Tài liệu học tập lớp 10 mà VnDoc tổng hợp biên soạn và đăng tải.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THPT miễn phí trên Facebook, mời bạn đọc tham gia nhóm Tài liệu học tập lớp 10 để có thể cập nhật thêm nhiều tài liệu mới nhất.








