Lý thuyết Hóa học 10 bài 20 KNTT
Lý thuyết Hóa lớp 10 bài 20: Ôn tập chương 6 được chúng tôi sưu tầm và tổng hợp các câu hỏi lí thuyết và trắc nghiệm có đáp án đi kèm nằm trong chương trình giảng dạy môn Hóa học lớp 10 sách Kết nối tri thức. Mời quý thầy cô cùng các bạn tham khảo tài liệu dưới đây.
Bài: Ôn tập chương 6
A. Lý thuyết Hóa học 10 bài 20
1. Tốc độ phản ứng
- Tốc độ phản ứng là độ biến thiên nồng độ của một chất trong các phản ứng hoặc sản phẩm trong một đơn vị thời gian. Trong đó theo quy ước: nồng độ theo mol/lít, thời gian có thể là giây (s), phút (ph), giờ (h)...
Tốc độ phản ứng được xác định bằng thực nghiệm.
- Tốc độ trung bình của phản ứng hóa học là tốc độ biến thiên trung bình nồng độ của một chất trong khoảng thời gian t1 đến t2.
![]() \(\overline V = - \frac{{{C_2} - {C_1}}}{{{t_2} - {t_1}}} = - \frac{{\Delta C}}{{\Delta t}}\)
\(\overline V = - \frac{{{C_2} - {C_1}}}{{{t_2} - {t_1}}} = - \frac{{\Delta C}}{{\Delta t}}\)
2. Các yếu tố ảnh hưởng đến tốc độ phản ứng
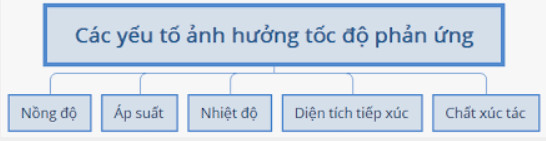
- Khi tăng nồng độ của chất phản ứng thì tốc độ phản ứng tăng.
- Đối với các phản ứng hóa học có chất khí tham gia, khi tăng áp suất thì tốc độ phản ứng tăng.
- Khi tăng nhiệt độ thì tốc độ phản ứng tăng.
- Đối với các phản ứng hóa học có chất rắn tham gia thì khi tăng diện tích bề mặt, tốc độ phản ứng tăng.
- Chất xúc tác làm tăng tốc độ phản ứng, nhưng không tiêu hao trong quá trình phản ứng.
- Chất ức chế phản ứng là chất làm giảm tốc độ phản ứng, nhưng không bị tiêu hao trong quá trình phản ứng.
B. Bài tập minh họa
Bài 1: Trong phòng thí nghiệm, có thể điều chế khí oxi từ muối kali clorat. Người ta sử dụng cách nào sau đây nhằm mục đích tăng tốc độ phản ứng?
A. Nung kaliclorat ở nhiệt độ cao.
B. Nung hỗn hợp kali clorat và mangan đioxit ở nhiệt độ cao.
C. Dùng phương pháp dời nước để thu khí oxi.
D. Dùng phương pháp dời không khí để thu khí oxi.
Hướng dẫn giải
Đáp án B.
2KClO3 → 2KCl + 3O2
Sử dụng MnO2 làm chất xúc tác
Bài 2: Cho 2 mẫu BaSO3 có khối lượng bằng nhau và 2 cốc chứa 50ml dung dịch HCl 0,1M như hình sau. Hỏi ở cốc nào mẫu BaSO3 tan nhanh hơn?
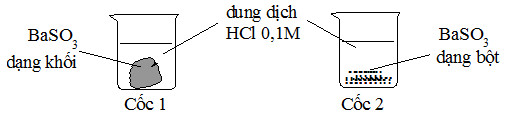
A. Cốc 1 tan nhanh hơn.
B. Cốc 2 tan nhanh hơn.
C. Tốc độ tan ở 2 cốc như nhau.
D. BaSO3 tan nhanh nên không quan sát được.
Hướng dẫn giải
Đáp án B.
Sử dụng yếu tố diện tích tiếp xúc, thí nghiệm 2: BaSO3 dạng bột sẽ làm tăng diện tích tiếp xúc, tốc độ phản ứng xảy ra nhanh hơn.
Bài 3: Cho phản ứng của các chất ở thể khí: I2 + H2 → 2HI
Biết tốc độ phản ứng tỉ lệ thuận với nồng độ các chất tham gia và phản ứng với số mũ là hệ số tỉ lượng của chất đó trong phương trình hóa học.
a) Hãy viết phương trình tốc độ của phản ứng này.
b) Ở một nhiệt độ xác định, hằng số tốc độ của phản ứng này là 2,5.10-4L/(mol.s).
Nồng độ đầu của I2 và H2 lần lượt là 0,02 M và 0,03 M. Hãy tính tốc độ phản ứng:
- Tại thời điểm đầu.
- Tại thời điểm đã hết một nửa lượng I2.
Hướng dẫn giải
a) v = k . CI2.CH2
Trong đó k là hằng số tốc độ phản ứng
CI2.CH2 lần lượt là nồng độ của I2 và H2 tại một thời điểm đang xét
b)
- Tốc độ phản ứng tại thời điểm đầu:
v = k . CI2.CH2 = 2,5 . 10-4 . 0,02 . 0,03 = 1,5 . 10-7(mol/(Ls))
- Tốc độ phản ứng tại thời điểm hết một nửa lượng I2
→ CI2= 0,01 M
CH2 = 0,02 M
v = k . CI2.CH2 = 2,5 . 10-4 . 0,01 . 0,02 = 5.10-8(mol/(Ls))
C. Trắc nghiệm Hóa học 10 bài 20
------------------------------
Như vậy, VnDoc.com đã gửi tới các bạn Lý thuyết Hóa học 10 bài 20: Ôn tập chương 6 KNTT Ngoài ra, các em học sinh có thể tham khảo môn Hóa 10 Cánh Diều, Lý 10 Cánh Diều và Toán 10 Chân trời sáng tạo tập 1, Sinh 10 Chân trời sáng tạo đầy đủ khác.








