Lý thuyết Hóa học 10 bài 2 KNTT
VnDoc xin giới thiệu bài Lý thuyết Hóa lớp 10 bài 2: Nguyên tố hóa học được chúng tôi sưu tầm và tổng hợp các câu hỏi lí thuyết và trắc nghiệm có đáp án đi kèm nằm trong chương trình giảng dạy môn Hóa học lớp 10 sách Kết nối tri thức. Mời quý thầy cô cùng các bạn tham khảo tài liệu dưới đây.
Mục lục bài viết
A. Lý thuyết Hóa học 10 bài 2
1. Nguyên tố hóa học
- Nguyên tố hoá học là tập hợp các nguyên tử có cùng số đơn vị điện tích hạt nhân. Trong nguyên tử, số đơn vị điện tích hạt nhân bằng số electron ở vỏ nguyên tử. Các electron trong nguyên tử quyết định tính chất hóa học của nguyên tử, nên các nguyên tử của cùng một nguyên tố hóa học có tính chất hóa học giống nhau.
Ví dụ: Tất cả nguyên tử có cùng số đơn vị điện tích hạt nhân là 6 đều thuộc nguyên tố carbon dù chúng có thể có số neutron khác nhau.
- Hiện nay, con người đã biết 118 nguyên tố hoá học, trong đó có 94 nguyên tố hoá học tồn tại trong tự nhiên và 24 nguyên tố được tạo ra trong phòng thí nghiệm, thậm chí có những nguyên tố mới chỉ tạo ra được một lượng rất ít, thời gian tồn tại rất ngắn.
2. Kí hiệu nguyên tử
- Số đơn vị điện tích hạt nhân nguyên tử của một nguyên tố hóa học (còn được gọi là số hiệu nguyên tử (Z) của nguyên tố đó) và số khối (A) là những đặc trưng cơ bản của một nguyên tử.
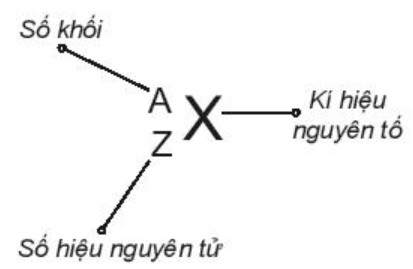
Hình 2.1. Kí hiệu nguyên tử
- Khi viết kí hiệu nguyên tử, đặt hai chỉ số đặc trưng ở bên trái kí hiệu nguyên tố, trong đó số hiệu nguyên tử Z ở phía dưới và số khối A ở phía trên.
- Ví dụ: Kí hiệu ![]() \(_2^4He\) cho biết nguyên tử helium có kí hiệu là He; số hiệu nguyên tử helium bằng 2 nên trong hạt nhân helium có 2 proton, vỏ nguyên tử có 2 electron; số khối của nguyên tử He là 4 nên trong hạt nhân có số neutron là 4 – 2 = 2.
\(_2^4He\) cho biết nguyên tử helium có kí hiệu là He; số hiệu nguyên tử helium bằng 2 nên trong hạt nhân helium có 2 proton, vỏ nguyên tử có 2 electron; số khối của nguyên tử He là 4 nên trong hạt nhân có số neutron là 4 – 2 = 2.
3. Đồng vị
Một số nguyên tử có cùng số đơn vị điện tích hạt nhân (có cùng số proton) nhưng có số neutron khác nhau. Những nguyên tử như thế gọi là các đồng vị (cùng vị trí trong bảng tuần hoàn các nguyên tố hóa học) của một nguyên tố hóa học.

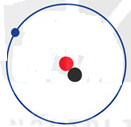
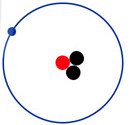
a) Protium (11H ) b) Deuterium ( 21H) c) Tritium (31H)
 Hạt electron
Hạt electron  Hạt proton
Hạt proton  Hạt neutron
Hạt neutron
Hình 2.2. Mô hình cấu tạo nguyên tử các đồng vị của nguyên tố hydrogen
- Các đồng vị khác nhau về số neutron nên khác nhau về khối lượng của hạt nhân nguyên tử, đồng thời khác nhau về một số tính chất vật lí.
- Ví dụ: Ở dạng đơn chất, đồng vị 3717 Cl có tỉ khối lớn hơn, nhiệt độ nóng chảy và nhiệt độ sôi cao hơn đồng vị 3517 Cl.
- Ngoài các đồng vị bền, các nguyên tố hóa học còn có một số đồng vị không bền. Các đồng vị không bền được gọi là đồng vị phóng xạ. Nhiều đồng vị phóng xạ được sử dụng trong y học, nông nghiệp, nghiên cứu khoa học,...
4. Nguyên tử khối
a. Nguyên tử khối
- Nguyên tử khối là khối lượng tương đối của nguyên tử. Nguyên tử khối của một nguyên tử cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử. Do khối lượng proton và neutron đều xấp xỉ 1,0 amu, còn khối lượng electron nhỏ hơn rất nhiều (0,00055 amu), nên có thể coi nguyên tử khối xấp xỉ số khối của hạt nhân.
- Ví dụ: Nguyên tử của nguyên tố potassium (K) CÓ Z = 19; số neutron = 20 nên nguyên tử khối của K là A = 19 + 20 = 39.
b. Nguyên tử khối trung bình
- Hầu hết các nguyên tố trong tự nhiên là hỗn hợp của nhiều đồng vị, mỗi đồng vị có tỉ lệ phần trăm số nguyên tử xác định. Nguyên tử khối của một nguyên tố là nguyên tử khối trung bình (kí hiệu là ![]() \(\overline A\)) của hỗn hợp các đồng vị của nguyên tố đó.
\(\overline A\)) của hỗn hợp các đồng vị của nguyên tố đó.
- Ví dụ: Bằng phương pháp phổ khối lượng, người ta xác định được trong tự nhiên, nguyên tố chlorine có hai đồng vị bền là 3517Cl (chiếm 75,77%) và 3717Cl (chiếm 24,23% số nguyên tử)
- Nguyên tử khối trung bình của Chlorine: ![]() \(\overline A = \frac{{\;\left( {75,77.35} \right) + \left( {24,23.37} \right)}}{{100}} = 35,48 \approx 35,5\)
\(\overline A = \frac{{\;\left( {75,77.35} \right) + \left( {24,23.37} \right)}}{{100}} = 35,48 \approx 35,5\)
B. Bài tập minh họa
Bài 1: Các nguyên tử có cùng số đơn vị điện tích hạt nhân thì có đặc điểm gì chung? Giữa số đơn vị điện tích hạt nhân, số proton và số electron có mối liên hệ như thế nào?
Hướng dẫn giải
- Các nguyên tử có cùng số đơn vị điện tích hạt nhân sẽ thuộc cùng loại nguyên tố hóa học
- Một nguyên tử trung hòa về điện có số proton = số electron. Mà số proton trong hạt nhân = số đơn vị điện tích hạt nhân
→ Số đơn vị điện tích hạt nhân = số proton = số electron
Bài 2: Hai nguyên tử Mg nặng gấp mấy lần nguyên tử O?
A. 1.
B. 2.
C. 3.
D. 4.
Hướng dẫn giải
Chọn C.
Khối lượng của 2 nguyên tử Mg là 2.24 = 48đvC.
Khối lượng của nguyên tử O là 16 đvC.
Tỉ lệ khối lượng của 2 nguyên tử Mg so với nguyên tử O là: 48 : 16 = 3 lần.
Vậy 2 nguyên tử magie nặng bằng 3 nguyên tử oxi.
Bài 3. Nguyên tố Bạc có 2 đồng vị trong tự nhiên là 107Ag chiếm 51,839% số nguyên tử. Tính số khối của đồng vị còn lại biết trong AgCl bạc chiếm 75,254% về khối lượng. Cho Cl = 35,5
Hướng dẫn giải
Gọi nguyên tử khối của bình của Ag là M.
→%mAg =M/(M+35,5) = 75,254%
→M = 107,9575
Gọi số khối của đồng vị còn lại là x, đồng vị này chiếm 48,161%
→ 107.51,839% + x.48,161% = 107,9575 → x = 109
C. Trắc nghiệm Hóa học 10 bài 2
------------------------------
Như vậy, VnDoc.com đã gửi tới các bạn Lý thuyết Hóa học 10 bài 2: Nguyên tố hóa học KNTT Ngoài ra, các em học sinh có thể tham khảo môn Hóa 10 Cánh Diều, Lý 10 Cánh Diều và Toán 10 Chân trời sáng tạo tập 1, Sinh 10 Chân trời sáng tạo đầy đủ khác.








