Lý thuyết Hóa học 10 bài 10 KNTT
Lý thuyết Hóa lớp 10 bài 10: Quy tắc Octet được VnDoc sưu tầm và tổng hợp các câu hỏi lí thuyết và trắc nghiệm có đáp án đi kèm nằm trong chương trình giảng dạy môn Hóa học lớp 10 sách Kết nối tri thức. Mời quý thầy cô cùng các bạn tham khảo tài liệu dưới đây.
Bài: Quy tắc Octet
A. Lý thuyết Hóa học 10 bài 10
1. Khái niệm liên kết hóa học
- Theo thuyết cấu tạo hóa học, sự liên kết giữa các nguyên tử tạo thành phân tử hay tinh thể được giải thích bằng sự giảm năng lượng khi các nguyên tử kết hợp lại với nhau. Khi tạo liên kết hóa học thì nguyên tử có xu hướng đạt tới cấu hình electron bền vững của khí hiếm.
- Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
- Trong các phản ứng hóa học, chỉ có các electron thuộc lớp ngoài cùng và phân lớp sát lớp ngoài cùng tham gia vào quá trình tạo thành liên kết (electron hoá trị).
- Các electron hóa trị của nguyên tử một nguyên tố được quy ước biểu diễn bằng các dấu chấm đặt xung quanh kí hiệu nguyên tố.
Bảng 10.1. Biểu diễn electron hoá trị của một số nguyên tử
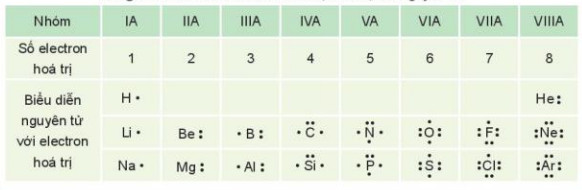
| Liên kết hoá học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn. |
|---|
2. Quy tắc Octet
- Khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm. Vì các khí hiếm (trừ helium) đều có 8 electron lớp ngoài cùng nên quy tắc này được gọi là quy tắc octet.
- Khi hình thành liên kết hóa học trong phân tử Cl2, nguyên tử chlorine có 7 electron hóa trị, mỗi nguyên tử chlorine cần thêm 1 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử chlorine góp chung 1 electron.
- Phân tử Cl2 được biểu diễn 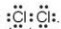
- Xung quanh mỗi nguyên tử chlorine đều có 8 electron.
- Khi hình thành liên kết hóa học trong phân tử H2O, nguyên tử hydrogen có 1 electron hoá trị, nguyên tử oxygen có 6 electron hóa trị, mỗi nguyên tử hydrogen cần thêm 1 electron và nguyên tử oxygen cần thêm 2 electron để đạt cấu hình electron bão hòa theo quy tắc octet.
- Phân tử H2O được biểu diễn 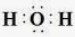 . Xung quanh nguyên tử oxygen có 8 electron.
. Xung quanh nguyên tử oxygen có 8 electron.
- Khi hình thành liên kết hóa học trong phân tử NaF, nguyên tử Na có 1 electron hóa trị, nguyên tử F có 7 electron hóa trị, nguyên tử Na nhường 1 electron hóa trị tạo thành hạt mang điện tích dương, nguyên tử F nhận 1 electron tạo thành hạt mang điện tích âm. Các hạt này đều đạt cấu hình electron bão hòa theo quy tắc octet và có điện tích trái dấu nên hút nhau.
- Quy tắc octet chỉ đúng cho sự tạo thành liên kết hóa học giữa các nguyên tử của các nguyên tố thuộc chu kì 2 của bảng tuần hoàn và một số nguyên tử của các nguyên tố có tính kim loại, phi kim điển hình. Ngoài ra có các ngoại lệ.
Ví dụ: Trong phân tử PCl5, lớp ngoài cùng của P có 10 electron.

| Quy tắc octet: Khi hình thành liên kết hoá học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm. |
|---|
B. Bài tập minh họa
Bài 1: Khi các nguyên tử kết hợp với nhau tạo thành phân tử theo một tỉ lệ xác định, yếu tố nào quyết định tỉ lệ số nguyên tử của mỗi nguyên tố trong phân tử đó?
Hướng dẫn giải
Hầu hết nguyên tử các nguyên tố trong bảng tuần hoàn đều không đủ 8 electron lớp ngoài cùng nên có xu hướng đạt cấu hình electron bền vững bằng cách kết hợp với các nguyên tử khác theo tỉ lệ nhất định.
Bài 2: Trình bày sự hình thành ion lithium. Cho biết ion lithium có cấu hình electron của khí hiếm tương ứng nào?
Hướng dẫn giải
- Nguyên tử Lithium cho đi 1 electron để tạo thành ion lithium
- Ion lithium có cấu hình electron của khí hiếm He
Bài 3: Vận dụng quy tắc octet, trình bày sơ đồ mô tả sự hình thành phân tử potassium chloride (KCI) từ nguyên tử của các nguyên tố potassium và chlorine
Hướng dẫn giải
- Phân tử potassium được hình thành bởi các ion K+ và Cl-.
- Nguyên tử nguyên tố potassium cho đi 1 electron tạo thành K+ để đạt cấu hình electron bền vững của Ar
- Nguyên tử nguyên tố chloride nhận 1 electron tạo thành Cl- để đạt cấu hình electron bền vững của Ar
C. Trắc nghiệm Hóa học 10 bài 10
------------------------------
Như vậy, VnDoc.com đã gửi tới các bạn Lý thuyết Hóa học 10 bài 10: Quy tắc Octet KNTT Ngoài ra, các em học sinh có thể tham khảo môn Hóa 10 Cánh Diều, Lý 10 Cánh Diều và Toán 10 Chân trời sáng tạo tập 1, Sinh 10 Chân trời sáng tạo đầy đủ khác.









